
| A. | 稀有气体元素 | |
| B. | 过渡元素 | |
| C. | 氟、氯、硫、磷元素 | |
| D. | 金属元素和非金属元素分界线附近的元素 |
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46g有机物C2H6O中含有极性共价键的数目一定为7NA | |
| B. | 标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA | |
| C. | 常温常压下,14g乙烯和丙烯的混合气体中含有的原子总数为3NA | |
| D. | 标准状况下,1mol苯分子中含有碳碳双键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
某无色溶液可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4- 中的几种。为确定其成分做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
A.肯定有Al3+ 、Mg2+、NH4+、Cl- B.肯定有Al3+、Mg2+、HCO3-
C.肯定有K+、HCO3-、MnO4- D.肯定有Al3+、Mg2+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去96%的乙醇中的少量水制无水乙醇:加入生石灰,振荡、静置、蒸馏 | |
| B. | 除去溴苯中混有的少量单质溴:加入足量的NaOH溶液,振荡、静置、分液 | |
| C. | CH4和CCl4中的化学键均为非极性键,CH4、CCl4都是正四面体结构 | |
| D. | 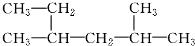 系统命名法为:2,4-二甲基-己烷 系统命名法为:2,4-二甲基-己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为相互串联的甲乙两电解池.试回答:
如图为相互串联的甲乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
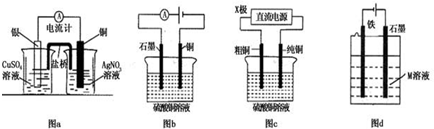
| A. | 图a是原电池装置,且较长时间内,电流计会显示有稳定电流产生 | |
| B. | 图b 电解足量硫酸铜溶液一段时间后,加入适量CuCO3固体,可以使硫酸铜溶液恢复到原浓度 | |
| C. | 图c中的X极若为负极,则该装置可实现粗铜的精炼 | |
| D. | 图d中若M是海水,该装置是通过“牺牲阳极保护法”使铁不被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有②③ | C. | 只有③④ | D. | 只有②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量相等 | B. | 失去电子的物质的量相等 | ||
| C. | 质量比为24:27:26 | D. | 质量比为12:18:28 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
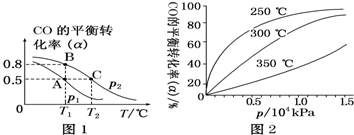 煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料.
煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com