
 s) + H2O(g)
s) + H2O(g)  CO(g) + H2(g) △H> 0
CO(g) + H2(g) △H> 0  CO2(g) + H2(g) △H < 0
CO2(g) + H2(g) △H < 0
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源:不详 题型:单选题
| A.需要加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件下一定能发生反应 |
| C.反应物和生成物所具有的总能量决定了放热还是吸热 |
| D.C(石墨,s)=C(金刚石,s)△H>0,所以金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0 (填“>”、“<”、“无法确定”)。
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0 (填“>”、“<”、“无法确定”)。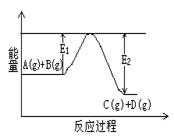
 O的热化学方程式为 。
O的热化学方程式为 。 化剂液态双氧水(H2O2)。
化剂液态双氧水(H2O2)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 存在;
存在; 2C(g) △H=QkJ·mol-1(Q<0)
2C(g) △H=QkJ·mol-1(Q<0)
| A.①③⑥ | B.②④⑤ | C.①③④ | D.③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.自发反应一定是放热反应 |
| B.自发反应一定是吸热反应 |
| C.有的吸热反应也能自发进行 |
| D.吸热反应不能自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C(s)+O2(g)="==CO(g)" ΔH ="—110.5" kJ/mol |
| B.C(s)+O2(g)===CO2(g) ΔH =-393.5 kJ/mol |
| C.2H2(g)+O2(g)===2H2O(l) ΔH =-571.6 kJ/mol |
| D.H2(g)+1/2O2(g)===H2O(g) ΔH =-241.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 列说法或表示方法中正确的是( )
列说法或表示方法中正确的是( )| A.等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应ΔH1>ΔH2 |
| B.由C(石墨)→C(金刚石);ΔH="+1.9KJ/mol" ,可知1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ,即金刚石比石墨稳定 |
| C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol |
| D.在稀溶液中:H+( aq )+OH-( aq)=H2O(l);ΔH="-57.3KJ/mol" ,若将0.5 mol浓H2SO4溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H
H )和强氧化剂H
)和强氧化剂H O
O ,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol 液态肼和足量液态H
,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol 液态肼和足量液态H O
O 反应生成氮气和水蒸气时放出256.64 kJ的热量。
反应生成氮气和水蒸气时放出256.64 kJ的热量。 O
O 反应的热化学方程式 。
反应的热化学方程式 。 O(l)="===" H
O(l)="===" H O(g);△H=+44kJ/mol,则16 g液态肼与足量液态H
O(g);△H=+44kJ/mol,则16 g液态肼与足量液态H O
O 反应生成氮气和液态水时,放出的热量是_____________________。
反应生成氮气和液态水时,放出的热量是_____________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com