
һ������XԪ�ع��ɵ���̬����X2������3�֣���Է��������ֱ�Ϊ32��34��36����֪������3�ַ�����֮��Ϊ15��4��1���ɴ˿���ȷ������
| A����������X2ȫ��ת��Ϊ����ͬ��������X3����ô�����ķ�������3�� |
| B��������Ϊ16��һ�ֺ����ڴ������е�ԭ�Ӱٷ���Ϊ85% |
| C��ֻҪ������ͬλ����ɲ��䣬Xԭ�����κ������·���������ϣ����õ�����X2��������֮������15��4��1 |
| D����������X2��ƽ����������34 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 4 |
| a2 |
| 4 |
| a2 |
| �� |
| �� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
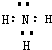
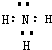
| ||
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-| 4 |
| 27 |
| 4 |
| 27 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012�����������������ѧ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ������XԪ�ع��ɵ���̬����X2������3�֣���Է��������ֱ�Ϊ32��34��36����֪������3�ַ�����֮��Ϊ15��4��1���ɴ˿���ȷ������
A����������X2ȫ��ת��Ϊ����ͬ��������X3����ô�����ķ�������3��
B��������Ϊ16��һ�ֺ����ڴ������е�ԭ�Ӱٷ���Ϊ85%
C ��ֻҪ������ͬλ����ɲ��䣬Xԭ�����κ������·���������ϣ����õ�����X2��������֮������15��4��1
D����������X2��ƽ����������34
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com