
用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是 ( )
| A.铜棒为正极,其电极反应式为:2H++2e-====H2↑ |
| B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出 |
| C.反应中消耗锌的质量为13 g |
| D.导线中通过电子的物质的量为0.2 mol |
C
解析试题分析:A、锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子放电,A正确;B、烧杯右侧碳棒与电源的负极相连为阴极,溶液中的铜离子放电,其电极表面有红色物质析出,B正确;C、反应一段时间后断开K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,这说明惰性电极电解硫酸铜溶液时阳极是氢氧根放电产生氧气,阴极是铜离子放电析出铜,电极反应式分别为4OH--4e-=2H2O+O2↑、2Cu2++4e-=2Cu。根据原子守恒可知,析出铜的物质的量是0.1mol,则反应中转移电子的物质的量是0.2mol。根据电子守恒可知锌失去电子的物质的量也是0.2mol,消耗锌的质量是0.1mol×65g/mol=6.5g,C不正确;D、导线中通过电子的物质的量为0.2 mol,D正确,答案选C。
考点:考查电化学原理的应用


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
| A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 |
| B.电池负极反应式为:O2 + 2H2O + 4e—= 4OH— |
| C.电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D.电池中c(KOH)不变;电解池中溶液pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是: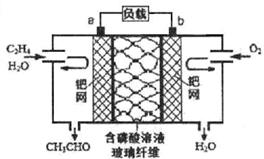
| A.该电池为可充电池 |
| B.每有0.1molO2反应,则迁移0.4mol |
| C.正极反应式为:CH2=CH2-2e-+2OH-=CH3CHO+H2O |
| D.电子移动方向:电极a→磷酸溶液 →电极b |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,碳钢腐蚀与溶液pH的关系如下:
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是
| A.在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 |
| B.粗铜精炼时,电解液中的c(Cu2+)保持不变 |
| C.Na+的焰色反应呈黄色,属于化学变化 |
| D.在滴定实验中,可以用碱式滴定管量取21.0 mL的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI + 3H2O KIO3 + 3H2↑。下列有关说法正确的是
KIO3 + 3H2↑。下列有关说法正确的是
| A.电解时,石墨作阴极,不锈钢作阳极 |
| B.电解时,阳极反应是:I –-6e–+ 3H2O = IO3 – + 6H+ |
| C.在KI溶液溶液中加入酚酞,电解时阳极区变红色 |
| D.电解时溶液中I –向阴极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
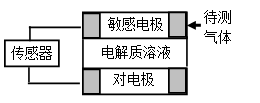
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示,用铅蓄电池电解100 g 10.0%的硫酸钠溶液,经过一段时间后,测得溶液质量变为95.5 g。下列说法正确的是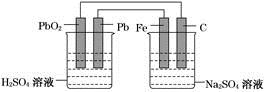
| A.电路中转移0.25 mol电子 |
| B.铅蓄电池中消耗0.5 mol H2SO4 |
| C.铅蓄电池的负极反应式为:PbSO4+2H2O-2e-===PbO2+4H++SO42- |
| D.Fe电极发生的电极反应为Fe-2e-===Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com