
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
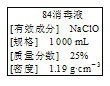
(1)该“84消毒液”的物质的量浓度约为___ mol·L-1。(取整数)
(2)某同学取100 mL 该“84消毒液”,稀释100倍后用于消毒,稀释后的溶液中c(Na+)=_____ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是____(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
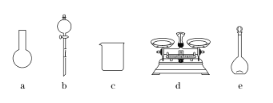
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
【答案】4.0 0.04 C
【解析】
(1)根据c=![]() 计算;
计算;
(2)根据稀释前后溶质的物质的量不变来计算;
(3)根据溶液的配制及c=![]() 、m=nM来分析判断。
、m=nM来分析判断。
(1)c(NaClO)=c=![]() =
=![]() =4.0 molL-1,故答案为:4.0;
=4.0 molL-1,故答案为:4.0;
(2)稀释后c(NaClO)=![]() ×4.0 molL-1=0.04 molL-1,c(Na+)=c(NaClO)=0.04 molL-1,故答案为:0.04;
×4.0 molL-1=0.04 molL-1,c(Na+)=c(NaClO)=0.04 molL-1,故答案为:0.04;
(3)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来配制和定容,图示的A、B两种仪器不需要,还需玻璃棒和胶头滴管两种玻璃仪器,故A错误;B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,一部分NaClO残留在烧杯中,导致NaClO偏少,溶液浓度偏低,故C正确;D.含NaClO质量分数为25%的消毒液的物质的量浓度为4.0 molL-1,应选取500 mL的容量瓶进行配制,所以需要NaClO的质量:0.5 L×4.0 molL-1×74.5 gmol-1=149 g,故D错误;故答案为:C。


科目:高中化学 来源: 题型:
【题目】(1)将质量比为4:5的SO2和SO3混合,则混合气体中SO2和SO3的物质的量之比为__,硫原子和氧原子个数之比为___。
(2)将5mol/L盐酸10mL稀释到200mL,稀释后溶液的物质的量浓度是__。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__。
(4)已知15.6gNa2X固体中含有0.4molNa+。请计算:
a.X的相对原子质量为__。
b.将39gNa2X固体溶解到水中,并加水稀释至2L,则所得溶液中Na+的物质的量浓度为___mol/L。
(5)质量都是10g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是__;密度最小的是__。(填化学式)
(6)漂白粉是用Cl2与___(填化学式)反应来制取的,漂白粉是___(填“混合物”或“纯净物”),其有效成分为__(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要750 mL 0.16 mol·L-1的NaCl溶液,有如下操作步骤:
A. 把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解,冷却至室温
B. 继续向容量瓶中加蒸馏水至液面距刻度线以下1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切
C. 用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶
D. 把A所得溶液小心转入一定容积的容量瓶中
E. 将容量瓶瓶塞塞紧,充分摇匀
请填写下列空白:
(1)简述容量瓶使用前必须进行的操作________________________________
(2)操作步骤的顺序为____________________(填序号)。
(3)实验室有如下规格的容量瓶:a.100 mL,B. 250 mL,C. 500 mL,d. 1000 mL,本实验选用__________(填序号)。
(4)本实验用到的基本实验仪器除容量瓶、药匙、玻璃棒、烧杯、量筒、胶头滴管外,还必须用到的仪器有____________,实验中玻璃棒的作用是_________________。
(5)本实验需用托盘天平称取NaCl晶体的质量是___________g。
(6)误差分析(填“偏高”“偏低”或“无影响”):
A. 某同学试验时未洗涤烧杯:____________。
B. 某同学观察液面的情况如图所示:____________。

C. 称取的食盐中混有Na2CO3杂质:___________。
(7) 已知所得溶液密度为1.04 g/mL,则所得溶液的质量分数为:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用双离子交换膜电解法可以处理含NH4NO3的工业废水,原理如图所示,下列叙述错误的是
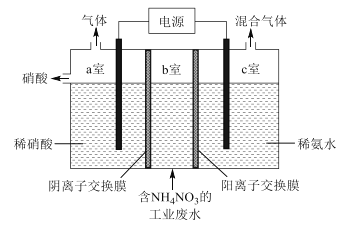
A. NH4+由b室向c室迁移
B. c室得到的混合气体是NH3和H2
C. 阳极反应式为2H2O -4e-=O2+4H+
D. 理论上外电路中流过1mol电子,可处理工业废水中0.5mol NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素 CO(NH2)2,原理如图。下列有关说法正确的是
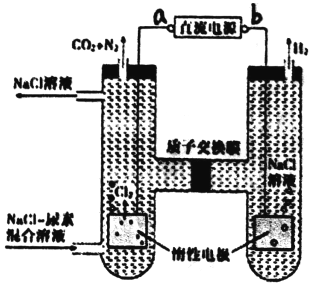
A. a为电源的负极
B. 电解前后,阴极室溶液的pH不变
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44L,则除去的尿素为7.2g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末由Na2O与Na2O2组成,将其分成等量的二份,一份与足量的CO2气体作用,发现该固体质量增加了10.0g,同时生成了新的气体A;另一份溶于过量的盐酸后,经蒸发结晶,最后得到固体的质量为35.1g,试计算:
(1)A气体在标况下的体积是_____________L
(2)固体中Na2O与Na2O2的物质的量之比是___________:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列空白:
(1)9gNH4+的物质的量为___,其中含电子的数目为___。(用NA表示)
(2)同温同压下:同体积的氨气和甲烷气体的质量比为___,同质量的氨气和甲烷气体的体积比为___。
(3)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为___。
(4)某无土栽培营养液中含有NH4+、Cl-、 K+、 SO42-,测得含0.6mol/LNH4+、0.5mol/LCl-、0.5mol/LK+,则SO42-的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:

下列说法正确的是
A. 粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B. 电解时用粗银作阴极,硝酸银溶液为电解质溶液
C. 用稀硫酸处理渣料时主要发生了氧化还原反应
D. 从滤液B中可以提取绿矾(FeSO4·7H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com