
【题目】下列叙述中正确的是
A. CO2的水溶液能导电,但CO2是非电解质
B. 盐酸能导电,所以盐酸是电解质
C. BaSO4难溶于水,所以是弱电解质
D. 强电解质溶液一定比弱电解质溶液导电性强
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 需要加热的反应一定是吸热反应
B. 不需要加热的反应一定是放热反应
C. 停止加热,反应就停止,该反应一定是吸热反应
D. 放热反应都会发光并产生火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
[实验一 焦亚硫酸钠的制取]
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5。
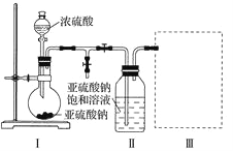
(1)装置Ⅰ中产生气体的化学方程式为____________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是____________________。
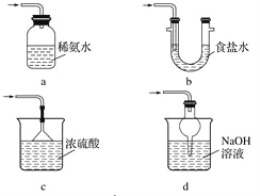
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填字母)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类、蛋白质、油脂和纤维素的说法中,正确的是
A. 它们的组成中都有C、H、O、N等元素
B. 在一定条件下,它们都能发生水解反应
C. 人体需要的二十多种氨基酸都可以通过人体自身合成
D. 油脂都是高级脂肪酸的甘油酯,是一种高热量营养素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾广泛用作氧化剂。现有一个氧化还原反应的体系中共有KMnO4、MnSO4、H2O、Fe2(SO4)3、
FeSO4、H2SO4、K2SO4七种物质。
Ⅰ.写出一个包含上述七种物质的氧化还原反应方程式(需要配平):____________。
Ⅱ.某研究性学习小组根据上述反应设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol/L,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液。

回答下列问题:
(1)此原电池的正极是石墨__________(填“a”或“b”),发生________反应。
(2)电池工作时,盐桥中的SO42-移向________(填“甲”或“乙”)烧杯。
(3)乙烧杯中的电极反应式分别为__________________。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。

请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是_____________;工业上制取A的离子方程式为________________。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应则C的化学式是_____________ ①的化学方程式为______________________________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是________。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为________。某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示实验合理的是( ) 
A.图1用于证明盐酸、碳酸、硅酸三种酸的酸性强弱
B.图2可“随控随停”制备少量氧气
C.图3用于配制100mL一定浓度硫酸溶液
D.图4用于制取并观察Fe(OH)2沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D. 25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里可用如图所示装置来制取氯酸钠、次氯酸钠和探究氯水的性质. 图中:
①为氯气发生装置;
②的试管里盛有15mL30%NaOH溶液来制取氯酸钠,并置于热水浴中;
③的试管里盛有15mL8%NaOH溶液来制取次氯酸钠,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过(仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式为; 实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有(填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL12molL﹣1的浓盐酸混合加热,充分反应后生成的氯气0.06mol.(填“大于”“小于”或“等于”),若有17.4g的MnO2被还原,则被氧化的HCl的物质的量为 .
(3)写出装置②中发生反应的化学方程式 .
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.
实验现象 | 原因 |
溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 | |
然后溶液从无色逐渐变为色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com