
| A. | 相对分子质量 M=$\frac{22.4mw}{[(1-w)V]}$ | B. | 物质的量浓度 c=$\frac{1000dV}{(MV+22.4m)}$ | ||
| C. | 溶质的质量分数 w=$\frac{MV}{22.4m}$ | D. | 溶液密度 d=$\frac{cM}{1000w}$ |
分析 A.根据溶液中m(溶剂):m(溶质)=ω(溶剂):(ω溶质)计算溶质的质量,再根据n=$\frac{VL}{22.4L/mol}$、M=$\frac{m}{n}$计算出摩尔质量,然后根据摩尔质量与相对分子质量的关系进行判断;
B.物质的量浓度c=$\frac{n}{V}$,n=$\frac{m}{M}$、V=$\frac{m}{d}$,据此计算出该溶液的物质的量浓度;
C.根据$\frac{VL}{22.4L/mol}$计算出该气体的物质的量,再根据m=nM计算出其质量,最后根据ω%=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算出该溶质的质量分数;
D.根据c=$\frac{1000ρw}{M}$计算出该溶液的密度.
解答 解:A.VL标况下的该气体的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,mg:m(溶质)=(1-w):w,所以m(溶质)=$\frac{mw}{1-w}$g,所以$\frac{V}{22.4}$mol×Mg/mol=$\frac{mw}{1-w}$g,解得:M=$\frac{22.4wm}{(1-w)V}$,所以该气体的相对分子质量为$\frac{22.4wm}{(1-w)V}$,故A正确;
B.VL标况下的该气体的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,该气体的质量为:$\frac{V}{22.4}$mol×Mg/mol=$\frac{MV}{22.4}$g,溶液的质量为:mg+$\frac{MV}{22.4}$g,形成溶液的体积为:
$\frac{mg+\frac{MV}{22.4}g}{1000dg/L}$,该溶液的物质的量浓度为:c=$\frac{n}{V}$=$\frac{\frac{V}{22.4}mol}{\frac{mg+\frac{MV}{22.4}g}{1000dg/L}}$=$\frac{1000dV}{MV+22.4m}$mol/L,故B正确;
C.VL标况下的该气体的物质的量为:n=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,该气体的质量为:$\frac{V}{22.4}$mol×Mg/mol=$\frac{MV}{22.4}$g,溶液的质量为:mg+$\frac{MV}{22.4}$g,则溶液中溶质的质量分数为:w=$\frac{\frac{MV}{22.4}g}{mg+\frac{MV}{22.4}g}$×100%=$\frac{MV}{22.4m+MV}$,故C错误;
D.根据c=$\frac{1000ρω}{M}$可得:d=$\frac{cM}{1000w}$,故D正确;
故选C.
点评 本题考查了物质的量浓度、溶质质量分数的计算方法,题目难度中等,注意掌握物质的量与摩尔质量、物质的量浓度等物理量之间的关系,明确物质的量浓度、溶质质量分数之间的转化关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳分子的比例模型: | B. | 如图所示一定代表丙烯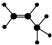 | ||
| C. | 12C32S2比12C34S2更易挥发 | D. | O${\;}_{2}^{2-}$电子式为: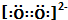 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 | B. | 1.6 | C. | 3.2 | D. | 3.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
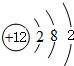 ,B+的离子结构示意图
,B+的离子结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 除杂试剂 | 分离方法 | |
| A | 硫酸亚铁溶液(硫酸铜) | 铁粉 | 结晶 |
| B | BaSO4(BaCO3) | 盐酸 | 过滤 |
| C | NaCl溶液(I2) | 乙醇 | 分液 |
| D | 铁粉(铜粉) | 硫酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
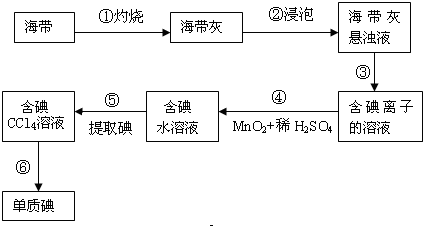
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
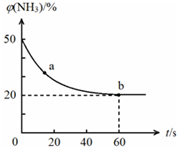 合理应用和处理氮的化合物,在生产生活中有重要意义.密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO(NH2)2 (s)+H2O(g),混合气体中NH3的物质的量分数[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率υ正(CO2)>b点的逆反应速率υ逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%.
合理应用和处理氮的化合物,在生产生活中有重要意义.密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO(NH2)2 (s)+H2O(g),混合气体中NH3的物质的量分数[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率υ正(CO2)>b点的逆反应速率υ逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
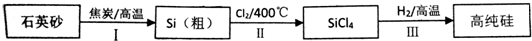
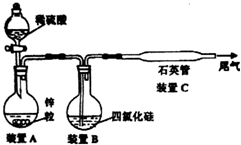
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com