
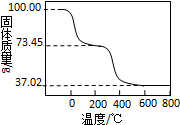
 碱式碳酸铝镁[MgxAly(OH)a(CO3)b?nH2O]可做为塑料填料.为确定某碱式碳酸铝镁的组成,进行如下实验:
碱式碳酸铝镁[MgxAly(OH)a(CO3)b?nH2O]可做为塑料填料.为确定某碱式碳酸铝镁的组成,进行如下实验:| 0.560L |
| 22.4L/mol |
| m |
| M |
| 0.560L |
| 22.4L/mol |
| m |
| M |
| 26.55g |
| 18g/mol |
| 0.560L |
| 22.4L/mol |
| 3.98g |
| 18g/mol |
| 32.45 |
| 44 |
| 32.45g |
| 44g/mol |


科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热23.15kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
| A、容器①、②中反应的平衡常数相等 |
| B、达平衡时,两个容器中XY3的物质的量浓度均为2mol?L-1 |
| C、容器②中反应达到平衡时放出的热量为Q |
| D、若将容器①体积缩小为0.20L,则达平衡时放出的热量大于23.15kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、置换、化合、分解、复分解 |
| B、化合、置换、复分解、分解 |
| C、化合、置换、分解、复分解 |
| D、置换、化合、复分解、分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在该反应中NaIO3作还原剂 |
| B、碱性条件下Na2H3IO6的氧化性小于Cl2 |
| C、反应中生成1molNa2H3IO6转移2mol电子 |
| D、反应中氧化产物与还原产物的物质的量之比为2:1. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com