
| A. | 100mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 | |
| D. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 |
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:填空题
 目前工业合成氨的原理是:
目前工业合成氨的原理是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
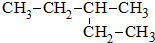
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入溴水中 | 溶液褪色 | SO2有漂白性 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已氧化变质 |
| C | 向饱和碳酸钠溶液中通入CO2 | 有晶体析出 | 溶解度:NaHCO3>Na2CO3 |
| D | 向盛有少量NaHCO3的试管中滴加草酸溶液 | 有气泡产生 | 酸性:草酸>碳酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 | |
| B. | 25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 | |
| C. | 25℃时,同浓度的NaCl溶液和氨水的导电能力 | |
| D. | 25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
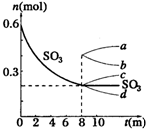 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KC1 | B. | MgCl2 | C. | Na2CO3 | D. | K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com