
【题目】在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法正确的是
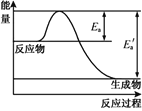
A.Ea为逆反应活化能,E为正反应活化能
B.该反应为放热反应,ΔH=Ea’-Ea
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
科目:高中化学 来源: 题型:
【题目】如图是制备乙炔和研究乙炔性质的实验装置图,下列有关说法错误的是( )
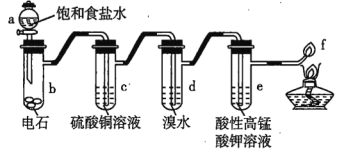
A.a中用饱和食盐水代替蒸馏水可使产生乙炔的速率更易控制
B.c中CuSO4 溶液的作用是除去影响后续实验的杂质
C.d、e中溶液褪色的原理不同,前者是氧化反应,后者是加成反应
D.f 处产生明亮、伴有浓烟的火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )
(1)常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+ c(H+)=c(OH-)+ c(CH3COO-)
(2)对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
(3)常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
(4)常温下,已知酯酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh:水的离子积为Kw:则有:Ka·Kh=Kw
(5)电解精炼铜时,电解质溶液中铜离子浓度不变
(6)如图装置中都盛有0.1mol/L的NaCl溶液,放置一段时间后,装置中的四块相同的锌片腐蚀速率由大到小的正确顺序是②①④③
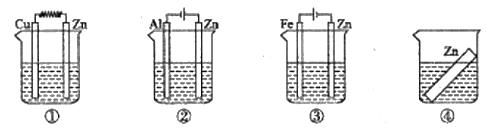
A.(1)(4)(6)
B.(1)(2)(4)(6)
C.(2)(4)(5)
D.(2)(3)(4)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究Zn与FeCl3溶液的反应,设计并完成了如下实验。
| 实验 | 条件 | 现象 |
ⅰ | 18℃ | 无明显气泡,0.5 min后有气体产生,一段时间后,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 | |
ⅱ | 65℃水浴 | 有气泡产生,12 s后,气泡非常明显,溶液很快转为红棕色,一段时间后,红棕色消失,最后产生红棕色沉淀 |
(1)实验ⅰ和ⅱ中均有气体产生,该气体为 ________。
(2)实验ⅱ中产生气体的速率明显快于实验ⅰ,可能的原因是________。
(3)“加铁氰化钾溶液有蓝色沉淀生成”说明混合溶液中存在________。
(4)实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化。研究小组猜想,可能是此实验条件下,氧化性H+>Fe3+。
查阅资料:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。根据资料小组同学设计了如下对比实验。
实验ⅲ | 实验ⅳ |
| _____________ |
①请在表格中画出实验ⅳ的装置图 。
②进行对比实验,观察到________,得出氧化性:Fe3+>H+。
研究小组进一步分析后,将Zn粒改为Zn粉,继续进行实验。
实验 | 条件 | 现象 |
ⅴ | 18℃,混合后不振荡 | 3 min后有明显的气泡产生,溶液颜色加深,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
ⅵ | 18℃,混合后振荡 | 气泡不明显,红棕色褪色明显,存在丁达尔现象,向混合后的溶液中加铁氰化钾溶液有蓝色沉淀生成 |
③对比实验ⅴ和ⅵ,解释“气泡不明显,红棕色褪色明显”的可能原因:________。
(5)结合实验探究过程及现象,影响Zn与FeCl3溶液的反应过程的条件有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断不正确的是
A. 生成44.8L N2(标准状况)
B. 有0.25 mol KNO3被还原
C. 转移电子的物质的量为1.75mol
D. 被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液中含有Al(OH)3、CuO和少量K2Cr2O7,为了得到含铬元素的溶液,常采用电解法,装置如图。a和b为电源的两极,c和d为石墨电极,A和B是电解产物,电解过程中C极室无色溶液变红。下列说法错误的是( )
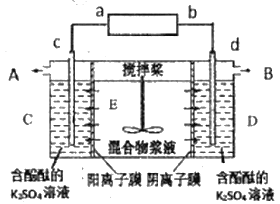
A.D室发生反应为:2H2O-4e-=4H++O2↑,得到含铬元素溶液,含铬元素的微粒是Cr2O72-
B.浆液中K+移向C室,C室产物是KOH和H2
C.b为正极,c为阴极,B是O2
D.E室最终得到Al(OH)3和CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)量取12.00mL溶液所用玻璃仪器的名称是______。
(2)按系统命名法命法,有机物![]() 的名称是______。
的名称是______。
(3)CaH2是离子化合物,写出CaH2的电子式______。。
(4)乙醇沸点高于二甲醚的主要原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com