
| A、碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、氧化铜与稀硫酸反应:CuO+2H+=Cu2++H2O |
| C、氢氧化钡和硫酸溶液反应:OH-+H+=H2O |
| D、铝与稀硫酸反应:Al+2H+=Al3++H2↑ |


科目:高中化学 来源: 题型:
| A、加热条件下均能与木炭反应 |
| B、长期露置在空气中浓度会升高 |
| C、常温下均不能用铝制容器贮存 |
| D、浓硫酸能使蔗糖炭化,说明浓硫酸具有吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体区别于其他分散系的本质特征是胶体分散质的微粒直径在10-9~10-7 m之间 | ||||
B、制备氢氧化铁胶体的化学方程式是FeCl3+3H2O
| ||||
| C、用平行光照射NaCl溶液和Fe(OH)3胶体时,产生相同的现象 | ||||
| D、Fe(OH)3胶体能使水中悬浮的固体颗粒沉降,以达到净水的目的,此无菌净水可直接饮用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将铜屑加入含Fe3+的溶液中:2Fe3++Cu═2Fe2++Cu2+ |
| B、将磁性氧化铁溶于盐酸中:Fe3O4+8H+═3Fe3++4H2O |
| C、向硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+═Fe3++4H2O |
| D、将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
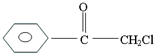
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
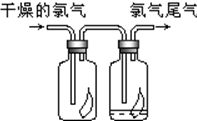 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式查看答案和解析>>
科目:高中化学 来源: 题型:
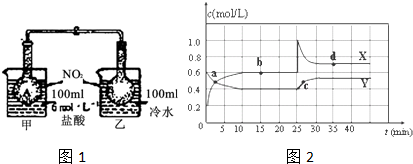
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com