

���� �ɷ���ʽ��֪AΪHC��CH�������Ȳ��C2H2�������ᣨC2H4O2���ķ���ʽ����B��C4H6O2��ΪA�����ᷢ���ӳɷ�Ӧ���ã�����BΪCH2=CHOOCCH3�������Ӿ۷�Ӧ����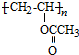 ��ˮ������CΪ
��ˮ������CΪ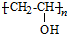 ���ɾ���ϩ������ȩ��֪DΪCH3CH2CH2CHO��HC��CH���ͪ��KOH�����·����ӳɷ�Ӧ����
���ɾ���ϩ������ȩ��֪DΪCH3CH2CH2CHO��HC��CH���ͪ��KOH�����·����ӳɷ�Ӧ����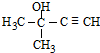 �������������ӳɷ�Ӧ����
�������������ӳɷ�Ӧ����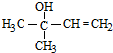 �����������������·�����ȥ��Ӧ���������ϩ�������ϩ�ڴ������·����Ӿ۷�Ӧ����
�����������������·�����ȥ��Ӧ���������ϩ�������ϩ�ڴ������·����Ӿ۷�Ӧ���� ���Դ˽����⣮
���Դ˽����⣮
��� �⣺�ɷ���ʽ��֪AΪHC��CH�������ᷢ���ӳɷ�Ӧ����BΪCH2=CHOOCCH3�������Ӿ۷�Ӧ����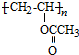 ��ˮ������CΪ
��ˮ������CΪ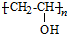 ���ɾ���ϩ������ȩ��֪DΪCH3CH2CH2CHO��HC��CH���ͪ��KOH�����·�Ӧ����
���ɾ���ϩ������ȩ��֪DΪCH3CH2CH2CHO��HC��CH���ͪ��KOH�����·�Ӧ����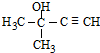 �������������ӳɷ�Ӧ����
�������������ӳɷ�Ӧ����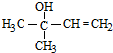 ���������������������������ϩ�������ϩ�ڴ������·����Ӿ۷�Ӧ����
���������������������������ϩ�������ϩ�ڴ������·����Ӿ۷�Ӧ���� ��
��
��1�������Ϸ�����֪AΪ��Ȳ��BΪCH2=CHOOCCH3�����еĹ�����Ϊ̼̼˫�����������ʴ�Ϊ����Ȳ��̼̼˫����������
��2��AΪHC��CH�������ᷢ���ӳɷ�Ӧ����BΪCH2=CHOOCCH3��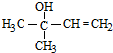 ���������������·�����ȥ��Ӧ���������ϩ��
���������������·�����ȥ��Ӧ���������ϩ��
�ʴ�Ϊ���ӳɷ�Ӧ����ȥ��Ӧ��
��3��DΪCH3CH2CH2CHO���ʴ�Ϊ��CH3CH2CH2CHO��
��4��3-��-3-��-1-��ϩһ�������·�����ȥ��Ӧ����CH2=C��CH3��-CH=CH2����ѧ����ʽΪCH2=CHC��CH3��2Cl+NaOH$��_{��}^{�Ҵ�}$CH2=C��CH3��-CH=CH2+NaCl+H2O��
�ʴ�Ϊ��CH2=CHC��CH3��2Cl+NaOH$��_{��}^{�Ҵ�}$CH2=C��CH3��-CH=CH2+NaCl+H2O��
��5����A������ͬ�����ŵ������ϩ������ͬ���칹��Ӧ����C��C�������ܵĽṹ��ʽ��CH3CH��CH3��-C��CH��CH3CH2CH2C��CH��CH3CH2C��CCH3�ȣ�
�ʴ�Ϊ��CH3CH��CH3��-C��CH��CH3CH2CH2C��CH��CH3CH2C��CCH3��
���� ����Ϊ2015��߿��⣬��Ŀ����ϩ����Ȳ�������ʵĿ��飬����������ѧ�����õķ�����������ѧ�������Ѷ����У�ע����������Ϣ���״���Ϊ�ṹ���жϺ�ͬ���칹�����д��


 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �¶ȣ��棩 ƽ��̬ | 260 | 270 | 280 | 290 | 300 | 310 |
| COת���ʣ�%�� | 92 | 87 | 82 | 80 | 72 | 62 |
| CH3OCH3���ʣ�%�� | 33 | 45 | 77 | 79 | 62 | 52 |
| A�� | ��Ӧ�١��ھ�Ϊ���ȷ�Ӧ | |
| B�� | 290��ʱ��Ӧ��Kֵ�ﵽ��� | |
| C�� | ƽ��ʱ����Ӧ�������CH3OH����������һ����� | |
| D�� | ����ѹǿ������CH3OCH3���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


| ���� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO2��g����3molH2��g�� | 1molCH3OH��g����1molH2O��g�� |
| ƽ��ʱc��CH3OH�� | C1 | C2 |
| ƽ��ʱ�����仯 | �ų�29.4kJ | ����akJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1����2����3����4�� | B�� | ��1����2�� | C�� | ��3����4�� | D�� | ��2����4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na$��_{��ȼ}^{O_{2}}$Na2O2$\stackrel{CO_{2}}{��}$Na2CO3 | |
| B�� | MgCO3$\stackrel{HCl}{��}$MgCl2��Һ$\stackrel{���}{��}$Mg | |
| C�� | Fe$��_{��ȼ}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{��}$Fe2��SO4��3 | |
| D�� | SiO2$\stackrel{HCl}{��}$SiCl4$\stackrel{H_{2}}{��}$Si |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �峿�������п���һ���ƵĹ��� | |
| B�� | ���м��������ʹ�����ʵȾ۳����ƳɿɿڵĶ��� | |
| C�� | FeCl3��Һ����NaOH��Һ�������ɫ���� | |
| D�� | ���õ�Ӿ�����ᡢ�齺���������ȵس����ڶƼ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com