
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)查阅资料知:草酸晶体175℃分解成CO2、CO、H2O,请写出草酸晶体分解的化学反应方程式:_____。
(2)请用下列的装置(图中加热装置已略去)分解草酸晶体以制备少量CO气体,最佳的连接顺序为:________。(填字母序号)
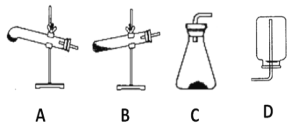
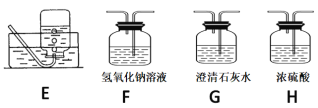
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____________(填序号)。
A.室温下,测0.1mol/L的H2C2O4溶液与H2SO4溶液的pH,硫酸溶液的pH比草酸的小;
B.室温下,取pH=3的H2C2O4溶液稀释100倍后,测其pH<5;
C.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL。
(4)现需要配制900mL1mol/L的草酸溶液。
①需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、_________、__________(填仪器名称)。
②下列操作会使所配溶液浓度偏低的是__________。(填字母)
A.称量时用了生锈的砝码
B.容量瓶未干燥即用来配制溶液
C.H2C2O4·2H2O晶体失去了部分结晶水
D.定容时,仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(5)用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①滴定过程中反应的离子方程式为_____________________________________________。
②量取KMnO4样品溶液应选用__________(填“酸式”或“碱式”)滴定管;若量取KMnO4样品溶液的滴定管用蒸馏水洗净后未润洗,则最终的测定结果将________(填“偏大”、“偏小”或“不变”)。
③现取KMnO4粗品10g,配成100mL溶液,取25.0 mL用(4)中配制的草酸溶液滴定,并进行3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,请问KMnO4粗品的质量分数为______________。(已知:KMnO4的摩尔质量为158g/mol)
【答案】H2C2O4·2H2O![]() CO↑+CO2↑ +3H2O↑A-F-G-EAB玻璃棒1000mL容量瓶DE2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O酸式偏小50.56%
CO↑+CO2↑ +3H2O↑A-F-G-EAB玻璃棒1000mL容量瓶DE2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O酸式偏小50.56%
【解析】
(1)草酸晶体的受热分解生成CO、CO2、水,根据得失电子守恒配平方程式;(2)给试管里的晶体加热时,为防止反应生成的水或所含结晶水在管口液化后倒流引起试管破裂,要求试管口要向下倾斜;为制备分解产物中的CO,先要排除已证明生成的CO2对实验的干扰,可用F装置吸收CO2气体,并利用G装置证明CO2已经除尽,最后用排水法收集CO;(3)证明草酸为弱酸需要证明溶液中存在电离平衡,弱酸形成的强碱弱酸盐是否水解或者与等浓度的强酸酸性强弱比较分析;(4) ①配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,用托盘天平称取草酸,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀;②根据![]() 分析误差;(5)①用草酸滴定KMnO4溶液,高锰酸根离子被还原为锰离子、草酸被氧化为二氧化碳;②KMnO4具有氧化性,能腐蚀橡胶; 根据c(待测)=
分析误差;(5)①用草酸滴定KMnO4溶液,高锰酸根离子被还原为锰离子、草酸被氧化为二氧化碳;②KMnO4具有氧化性,能腐蚀橡胶; 根据c(待测)=![]() 分析误差;③3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,第一次实验消耗草酸溶液的体积偏离正常误差,根据第二次、第三次实验数据消耗草酸溶液的平均体积是20.00 mL,根据2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O计算高锰酸钾的纯度。
分析误差;③3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,第一次实验消耗草酸溶液的体积偏离正常误差,根据第二次、第三次实验数据消耗草酸溶液的平均体积是20.00 mL,根据2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O计算高锰酸钾的纯度。
(1)草酸晶体的受热分解生成CO、CO2、水,根据得失电子守恒,CO、CO2的比为1:1,方程式是H2C2O4·2H2O![]() CO↑+CO2↑ +3H2O↑;(2)给试管里的晶体加热时,为防止反应生成的水或所含结晶水在管口液化后倒流引起试管破裂,要求试管口要向下倾斜;为制备分解产物中的CO,先要排除已证明生成的CO2对实验的干扰,可用F装置吸收CO2气体,并利用G装置证明CO2已经除尽,最后用排水法收集CO,所以最佳的连接顺序为A-F-G-E;(3)A.室温下,测0.1mol/L的H2C2O4溶液与H2SO4溶液的pH,硫酸溶液的pH比草酸的小,说明草酸溶液中存在电离平衡,证明草酸是弱酸,故A正确; B.室温下,取pH=3的H2C2O4溶液稀释100倍后,测其pH<5,说明稀释促进电离,溶液中存在电离平衡,为弱酸,故B正确;C.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL,强酸和弱酸都符合,和强酸弱酸无关,故C错误;(4) ①配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,用托盘天平称取草酸,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀;所以需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、1000mL容量瓶。 ②A.称量时用了生锈的砝码,草酸物质的量偏大,会使所配溶液浓度偏高,故不选A; B.容量瓶未干燥即用来配制溶液,无影响,故不选B; C.H2C2O4·2H2O晶体失去了部分结晶水,草酸物质的量偏大,会使所配溶液浓度偏高,故不选C; D.定容时,仰视刻度线,溶液体积偏大,会使所配溶液浓度偏低,故选D; E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,溶液体积偏大,使所配溶液浓度偏低,故选E。(5)①用草酸滴定KMnO4溶液,高锰酸根离子被还原为锰离子、草酸被氧化为二氧化碳,反应离子方程式是2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O;②KMnO4具有氧化性,能腐蚀橡胶,所以量取KMnO4样品溶液应选用酸式滴定管;若量取KMnO4样品溶液的滴定管用蒸馏水洗净后未润洗,造成高锰酸钾的物质的量偏小,消耗草酸的的体积偏小, 根据c(待测)=
CO↑+CO2↑ +3H2O↑;(2)给试管里的晶体加热时,为防止反应生成的水或所含结晶水在管口液化后倒流引起试管破裂,要求试管口要向下倾斜;为制备分解产物中的CO,先要排除已证明生成的CO2对实验的干扰,可用F装置吸收CO2气体,并利用G装置证明CO2已经除尽,最后用排水法收集CO,所以最佳的连接顺序为A-F-G-E;(3)A.室温下,测0.1mol/L的H2C2O4溶液与H2SO4溶液的pH,硫酸溶液的pH比草酸的小,说明草酸溶液中存在电离平衡,证明草酸是弱酸,故A正确; B.室温下,取pH=3的H2C2O4溶液稀释100倍后,测其pH<5,说明稀释促进电离,溶液中存在电离平衡,为弱酸,故B正确;C.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL,强酸和弱酸都符合,和强酸弱酸无关,故C错误;(4) ①配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,用托盘天平称取草酸,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀;所以需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、1000mL容量瓶。 ②A.称量时用了生锈的砝码,草酸物质的量偏大,会使所配溶液浓度偏高,故不选A; B.容量瓶未干燥即用来配制溶液,无影响,故不选B; C.H2C2O4·2H2O晶体失去了部分结晶水,草酸物质的量偏大,会使所配溶液浓度偏高,故不选C; D.定容时,仰视刻度线,溶液体积偏大,会使所配溶液浓度偏低,故选D; E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,溶液体积偏大,使所配溶液浓度偏低,故选E。(5)①用草酸滴定KMnO4溶液,高锰酸根离子被还原为锰离子、草酸被氧化为二氧化碳,反应离子方程式是2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O;②KMnO4具有氧化性,能腐蚀橡胶,所以量取KMnO4样品溶液应选用酸式滴定管;若量取KMnO4样品溶液的滴定管用蒸馏水洗净后未润洗,造成高锰酸钾的物质的量偏小,消耗草酸的的体积偏小, 根据c(待测)=![]() ,最终的测定结果将偏小;③3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,第一次实验消耗草酸溶液的体积偏离正常误差,根据第二次、第三次实验数据消耗草酸溶液的平均体积是20.00 mL,设高锰酸钾的纯度为x%,
,最终的测定结果将偏小;③3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,第一次实验消耗草酸溶液的体积偏离正常误差,根据第二次、第三次实验数据消耗草酸溶液的平均体积是20.00 mL,设高锰酸钾的纯度为x%,
2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O
2 5
![]() 1mol/L
1mol/L![]() 0.02L
0.02L
X%=50.56%


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如下图所示装置进行有关实验。
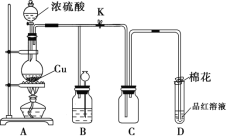
(1)装置A中发生反应的化学方程式为_________________________________________;
(2)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是________________,B中应放置的溶液是________(填字母);
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(3)若装置C中盛有酸性KMnO4溶液,反应现象为_____________________,体现该气体的_____________(填“氧化性”或“还原性”);
(4)装置D中试管口放置的棉花应浸一种溶液,这种溶液是_____________,其作用是___________;
(5)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,反应完毕时,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列有关说法错误的是( )
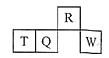
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. T的单质是两性物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是一个四肽,它可看作是4个氨基酸缩合掉3分子水而得,![]() ,式中的R,R′、R″、R可能是相同的或不同的烃基或有取代基的烃基.﹣NH﹣CO﹣称为肽键,今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:
,式中的R,R′、R″、R可能是相同的或不同的烃基或有取代基的烃基.﹣NH﹣CO﹣称为肽键,今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:

问:
(1)这个“多肽”是_________肽;
(2)该多肽水解后,有_________个谷氨酸;
(3)该多肽水解后,有_________个苯丙氨酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的离子反应方程式正确的是
A. 少量的 SO2 通入 NaClO 溶液:SO2+H2O+2ClO-=SO32-+2HClO
B. 氧化铁溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
C. 用二氧化锰和浓盐酸反应制氯气:MnO2+4HCl(浓)![]() Mn2++2Cl―+Cl2↑+2H2O
Mn2++2Cl―+Cl2↑+2H2O
D. 等浓度的 NaHSO4 与 Ba(OH)2 混合至溶液呈中性:Ba2++2OH―+SO42―+2H+=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:

(1)装置应盛放的试剂是I ____,IV _______(将下列有关试剂的序号填入空格内);
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是____________________________;
(3)使用装置II的目的是____________________________________ ;
(4)使用装置III的目的是 ___________________________________;
(5)确定含有乙烯的现象是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法不正确的是

A. 元素X的最高价氧化物对应水化物的化学式为H3PO4
B. 元素Y有两种常见的氧化物且都能与元素R的氢化物反应生成对应价态的酸
C. R、X、Y三者的气态氢化物稳定性依次增强
D. Z的单质能与Y的某些化合物发生置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com