
 ��ҵ�����������ѵķ����࣮ܶ����������Ҫ�ɷ�FeTiO3������������Ϊ��Ҫԭ��ұ�������ѣ������Ĺ�������ͼ��ͼ��������������Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽΪ��FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
��ҵ�����������ѵķ����࣮ܶ����������Ҫ�ɷ�FeTiO3������������Ϊ��Ҫԭ��ұ�������ѣ������Ĺ�������ͼ��ͼ��������������Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽΪ��FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O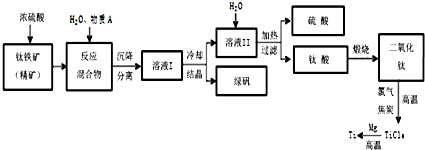
���� ����������Ҫ�ɷ�FeTiO3������������Ϊ��Ҫԭ��ұ�������ѣ�������ʯ����Ũ���ᣬ��������Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽΪ��FeTiO3+2H2SO4�TTiOSO4+FeSO4+2H2O������ˮ�ܽ���������ֹ�������ӱ���������������õ���Һ����ȴ�ᾧ�õ������������壬���˵õ���Һ��ΪTiOSO4�����ȹ��˵õ���ҺΪ���ᣬ����Ϊ���ᣬ���յõ��������ѣ����������ͽ�̿���·�Ӧ���ɶ���������ȡ���Ȼ��ѣ�����þ��Ӧ��Ar�����н��У������ķ�ӦΪ��TiCl4+2Mg�T2MgCl2+Ti��
��1������������ԭ��Ӧ��Ԫ�صĻ��ϼ۷����仯�����жϣ�
��2�����������ױ�����Ϊ�����ӣ�������������Է�������������������ȷ�����õ��ĸ�����Ϳɻ������õ����ʣ�
��3��Mg��Ti���н�ǿ��ԭ�ԣ��ڸ����¶��ױ������е�O2������þ�͵���������̼����Ӧ��
��4���ٸ��ݷ�Ӧ�ܷ��Է����е��оݡ�H-T��S���жϣ�
����֪��Ӧa��TiO2��s��+2Cl2��g��+2C��s��=TiCl4��g��+2CO��g����H1=-72kJ•mol-1
b��TiO2��s��+2Cl2��g��=TiCl4��g��+O2��g����H2=+38.8kJ•mol-1
c��C��s��+CO2��g��=2CO��g��?��H3=+282.8kJ•mol-1��
���ø�˹���ɽ�a-b-c�ɵ÷�ӦC��s��+O2��g��=CO2 ��g���ġ�H��
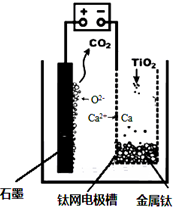
��5��������װ��ͼ�����жϣ��������ɶ�����̼���壬�ǵ�����е�������ʧ������������������������ʯī��Ӧ���ɵĶ�����̼��
���Ʊ�TiO2ʱ���ڵ��۷������·�Ӧ��������2Ca2++4e-�T2Ca ������2O2--4e-�TO2����2Ca+TiO2=Ti+2CaO���ɴ˿ɼ���CaO�������䣮
��� �⣺����������Ҫ�ɷ�FeTiO3������������Ϊ��Ҫԭ��ұ�������ѣ�������ʯ����Ũ���ᣬ��������Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽΪ��FeTiO3+2H2SO4�TTiOSO4+FeSO4+2H2O������ˮ�ܽ���������ֹ�������ӱ���������������õ���Һ����ȴ�ᾧ�õ������������壬���˵õ���Һ��ΪTiOSO4�����ȹ��˵õ���ҺΪ���ᣬ����Ϊ���ᣬ���յõ��������ѣ����������ͽ�̿���·�Ӧ���ɶ���������ȡ���Ȼ��ѣ�����þ��Ӧ��Ar�����н��У������ķ�ӦΪ��TiCl4+2Mg�T2MgCl2+Ti��
��1�����������Ļ�ѧʽΪFeTiO3��������Ԫ�صĻ��ϼ�Ϊ+2�ۣ���Ԫ�صĻ��ϼ�Ϊ-2�ۣ��ѵĻ��ϼ�Ϊ+4�ۣ��������Ũ���ᷴӦ��TiOSO4���ѵĻ��ϼ�Ϊ+4�ۣ���Ϊ+6�ۣ���Ԫ�صĻ��ϼ�Ϊ-2�ۣ�FeSO4����Ԫ�صĻ��ϼ�Ϊ+2�ۣ���Ԫ�صĻ��ϼ�Ϊ-2�ۣ����ϼ۵ı仯���Ƿ�������ԭ��Ӧ��
�ʴ�Ϊ����������ԭ��Ӧ��
��2�����������ױ�����Ϊ�����ӣ�������������Է���������������A�ǽ��������������̣����õ��ĸ��������̷����ɻ������õ����������ᣬ
�ʴ�Ϊ��Fe���̷������
��3��Mg��Ti���н�ǿ��ԭ�ԣ��ڸ����¶��ױ������е�O2������þ�Ͷ�����̼��Ӧ��������þ��̼��þ�͵�����Ӧ���ɵ���þ�����Է�ӦTiCl4+2Mg=2MgCl2+Ti����Ar�����н��У�
�ʴ�Ϊ����ֹ������Mg��Ti������е�������������������̼�����ã�
��4���ٸ��ݷ�Ӧ�ܷ��Է����е��оݡ�H-T��S����H��0�����Ը����²��Է����У�˵���÷�Ӧ�ġ�S��0���������ӣ����ʴ�Ϊ����S��0���������ӣ���
����֪��Ӧa��TiO2��s��+2Cl2��g��+2C��s��=TiCl4��g��+2CO��g����H1=-72kJ•mol-1
b��TiO2��s��+2Cl2��g��=TiCl4��g��+O2��g����H2=+38.8kJ•mol-1
c��C��s��+CO2��g��=2CO��g��?��H3=+282.8kJ•mol-1
���ݸ�˹���ɣ���ӦC��s��+O2��g��=CO2��g�����Կ�����a-b-c��ã����Ըû�ѧ��Ӧ���ʱ��H=-72kJ•mol-1-282.8kJ•mol-1-38.8kJ•mol-1=-393.6 kJ/mol��
�ʴ�Ϊ��-393.6 kJ/mol��
��5������ʯī������������������������CaF2-CaO������ʣ���������������Ӧ�����������ƽ���������ԭ��Ӧ������ͼʾ����ɿ�֪���������ɶ�����̼���壬�ǵ�����е�������ʧ������������������������ʯī��Ӧ���ɵĶ�����̼�����Ե缫��ӦΪ��2O2--4e-=O2������C+2O2--4e-=CO2����
�ʴ�Ϊ��2O2--4e-=O2����C+2O2--4e-=CO2����
���Ʊ�TiO2ʱ���ڵ��۷������·�Ӧ��2CaO�T2Ca+O2����2Ca+TiO2$\frac{\underline{\;һ������\;}}{\;}$Ti+2CaO���ɴ˿ɼ���CaO�������䣻
���Ʊ�TiO2ʱ���ڵ��۷������·�Ӧ��������2Ca2++4e-�T2Ca ������2O2--4e-�TO2����2Ca+TiO2 $\frac{\underline{\;һ������\;}}{\;}$Ti+2CaO���ɴ˿ɼ���CaO�������䣻
�ʴ�Ϊ���Ʊ�TiO2ʱ���ڵ��۷������·�Ӧ��2CaO�T2Ca+O2����2Ca+TiO2$\frac{\underline{\;һ������\;}}{\;}$Ti+2CaO���ɴ˿ɼ���CaO�������䣮
���� ���������������ʽ�ۺϿ���Ԫ�ػ����������֪ʶ��Ϊ�߿��������ͣ��漰�������ʵ�Ӧ�ã��������ʵ�Ӧ�ã���������ķ���������ԭ����Ӧ�ã��缫��Ӧ����дԭ��ȣ�Ҫ��ѧ�����з����ͽ�����������������������ѧ�������õĿ�ѧ��������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | Na2CO3������CO2�� | B�� | NaHCO3������CO2�� | ||
| C�� | NaHCO3�ķ�Ӧ���ʿ� | D�� | ���߲���CO2һ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ����H+ | B�� | ��Һ��pH��7 | C�� | ��Һ��ֻ��OH- | D�� | ��Һ��c��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼ԭ�Ӳ�ȡsp�ӻ� | B�� | CO2���������Ľṹ | ||
| C�� | �ɱ���ԭ�Ӿ��� | D�� | CO2Ϊ���Է��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ķ���ϩ�Ļ�ѧ��Ժ�ǿ | B�� | ���ķ���ϩ�����к���˫�� | ||
| C�� | ���ķ���ϩ�ĵ����Dz������� | D�� | ���ķ���ϩ�з�������������76% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��� | �¶ȣ��棩 | ��ʼ���ʵ��� ��mol�� | ƽ�����ʵ��� ��mol�� | �ﵽƽ������ʱ�� ��s�� | |
| PCl5��g�� | PCl3��g�� | Cl2��g�� | |||
| �� | 320 | 0.40 | 0.10 | 0.10 | t1 |
| �� | 320 | 0.80 | t2 | ||
| �� | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A�� | ƽ�ⳣ��K�������������� | |
| B�� | ��Ӧ����ƽ��ʱ��PCl5��ת���ʣ������������� | |
| C�� | ��Ӧ����ƽ��ʱ������I�е�ƽ������Ϊv��PCl5��=$\frac{0.10}{{t}_{1}}$mol/��L•s�� | |
| D�� | ��ʼʱ���������г���PCl5 0.30 mol��PCl30.45 mol��Cl20.10 mol����Ӧ�����淴Ӧ������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com