
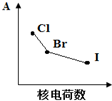
| A. | 原子半径 | B. | 氢化物的稳定性 | C. | 电子层数 | D. | 单质的熔沸点 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

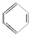 ;④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号);HCHO分子的空间构型为平面三角形.
;④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号);HCHO分子的空间构型为平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
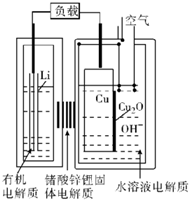 近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池放电时的反应过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池放电时的反应过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 放电时,Cu作电池的负极 | |
| C. | 通空气时,铜被氧化,表面产生Cu2O | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
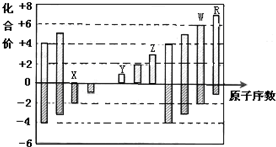
| A. | X的氢化物形成的晶体中存在的最强作用力是分子间作用力 | |
| B. | R的气态氢化物溶于水,离子键断裂 | |
| C. | W的气态氢化物是离子化合物 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚、酒精、福尔马林均可用于消毒杀菌 | |
| B. | 硝基苯转化成苯胺(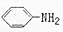 )的过程属于氧化反应 )的过程属于氧化反应 | |
| C. | 甲苯与浓硝酸、浓硫酸的混合酸反应可以获得邻、对位硝基甲苯 | |
| D. | 用食醋可除去热水壶内壁的水垢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com