
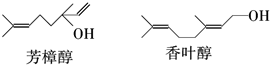
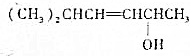 的键线式结构为
的键线式结构为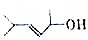 下列说法不正确的是( )
下列说法不正确的是( )| A. | 两种醇都能与溴水反应 | |
| B. | 两种醇互为同分异构体 | |
| C. | 两种醇与氧气在铜催化的条件下,均可被氧化为相应的醛 | |
| D. | 两种醇在浓H2S04存在下加热,均可与乙酸发生酯化反应 |
分析 A.两种醇都含有碳碳双键,均能与溴水发生加成反应;
B.两种物质的分子式相同,但结构式不同,互为同分异构体;
C.芳樟醇中的羟基连接的碳上没有氢,不能被催化氧化;香叶醇羟基连接的碳上有2个氢,能被催化氧化为醛;
D.两种醇都含-OH,能与乙酸在浓硫酸加热的条件下发生酯化反应;
解答 解:A.两种醇都含有碳碳双键,均能与溴水发生加成反应,故A正确;
B.两种物质的分子式相同,但结构式不同,互为同分异构体,故B正确;
C.芳樟醇中的羟基连接的碳上没有氢,不能被催化氧化;香叶醇羟基连接的碳上有2个氢,能被催化氧化为醛,故C错误;
D.两种醇都含-OH,能与乙酸在浓硫酸加热的条件下发生酯化反应,故D正确;
故选C.
点评 本题考查有机物的结构与性质,注意把握有机物的官能团与性质的关系,熟悉烯烃、醇的性质即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正化合价与最低负化合价的代数和为6,D是同周期中离子半径最小的元素.
已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正化合价与最低负化合价的代数和为6,D是同周期中离子半径最小的元素.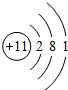 ,用电子式写出C和E形成化合物的过程
,用电子式写出C和E形成化合物的过程 ,用电子式写出A和B形成化合物的过程
,用电子式写出A和B形成化合物的过程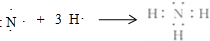 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质钠放入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | 二氧化硅溶于NaOH溶液:SiO2+2OH-═SiO32-+H2O | |
| C. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应2CO(g)→2C(s)+O2(g);△H>0不能自发进行,加入适当的催化剂可以自发 | |
| B. | 粗铜电解精炼时,阳极减少的质量与阴极增加的质量一定相同 | |
| C. | 体积均为10mL pH均为2的盐酸与醋酸,分别加入0.1g Zn,最终醋酸产生的H2多 | |
| D. | 一定条件下反应2NO2(g)?N2O4(g)达到平衡时,v(NO2)逆=2v(N2O4)正 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)>c(SO42-)>c(NH4+) | |
| B. | c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) | |
| D. | 室温下滴加NaOH溶液至溶液呈中性后:c(Na+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,7.0g由乙烯与丙烯组成的混合物中含有氢原子的数目为NA | |
| C. | 1mol Al3+含有的核外电子数为3NA | |
| D. | 某密闭容器装有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com