
【题目】二甲醚作为燃料电池的原料,可通过以下途径制取:
I.2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH
CH3OCH3(g)+H2O(g) ΔH
II.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH
CH3OCH3(g)+3H2O(g) ΔH
(1)已知:①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
③CH3OCH3(g)+ H2O(g)![]() 2CH3OH(g) ΔH3=+23.5kJ·mol-1
2CH3OH(g) ΔH3=+23.5kJ·mol-1
则反应I的ΔH=_______kJ·mol-1
(2)在10L恒容密闭容器中,均充入4molCO2和7molH2,分别以铱(Ir)和铈(Ce)作催化剂,通过反应II制二甲醚,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1所示。
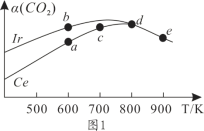
①根据图1,下列说法不正确的是________。
A.反应II的ΔH<0,ΔS>0
B.600K时,H2的速率:v(b)正>v(a)逆
C.分别用Ir、Ce作催化剂时,Ce使反应II的活化能降低更多
D.从状态d到e,α(CO2)减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=______(保留3位有效数字)。
(3)写出二甲醚碱性(电解质溶液为KOH溶液)燃料电池的负极电极反应式____________________________。
【答案】—203.5 A、C 6.75×104 CH3OCH3 +16OH——12e—=2CO32-+11H2O
【解析】
(1)根据已知反应的反应热和盖斯定律,①×2+②×2— ③ 计算可得ΔH;
(2)①A.由图中信息可知,当温度高于800K时,CO2转化率α(CO2)随反应温度升高而减小,说明该反应为放热反应,ΔH>0,同时该反应气体体积减小,ΔS<0;
B.由图可知,b点CO2转化率α(CO2)大于a点,生成物浓度b点大于a点,故v(b)逆>v(a)逆,由于b点平衡正向进行,v(b)正>v(b)逆,所以v(b)正>v(a)逆;
C.由图中信息可知,当温度为400K![]() 800K时,反应进行相同时间后测得Ir作催化剂的CO2转化率α(CO2)较高,说明Ir的催化效率更高,所以,用Ir、Ce作催化剂时,反应的活化能降低更多的是Ir;
800K时,反应进行相同时间后测得Ir作催化剂的CO2转化率α(CO2)较高,说明Ir的催化效率更高,所以,用Ir、Ce作催化剂时,反应的活化能降低更多的是Ir;
D.状态d、e都是平衡状态,从d到e,该反应为放热反应,升温平衡逆向移动,α(CO2)减小。
②列出三行式,根据二氧化碳平衡转化率,求出平衡时各组份的浓度,再根据平衡常数计算式计算;
(3)根据电池反应式可知,CH3OCH3在反应中被氧化,O2被还原,CH3OCH3在负极上反应。又因为是碱性溶液不可能有H+参加或生成,根据电子守恒、电荷守恒和原子守恒书写负极反应式。
(1)已知:①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
③CH3OCH3(g)+ H2O(g)![]() 2CH3OH(g) ΔH3=+23.5kJ·mol-1
2CH3OH(g) ΔH3=+23.5kJ·mol-1
根据盖斯定律,①×2+②×2— ③ 得ΔH=(-41.0 kJ·mol-1)×2+(-49.0kJ·mol-1)×2-(+23.5kJ·mol-1)= -203.5kJ·mol-1
故答案为:—203.5;
(2)①A.由图中信息可知,当温度高于800K时,CO2转化率α(CO2)随反应温度升高而减小,说明该反应为放热反应,ΔH>0,同时该反应气体体积减小,ΔS<0,故A错误;
B.由图可知,b点CO2转化率α(CO2)大于a点,生成物浓度b点大于a点,故v(b)逆>v(a)逆,由于b点平衡正向进行,v(b)正>v(b)逆,所以v(b)正>v(a)逆,故B正确;
C.由图中信息可知,当温度为400K![]() 800K时,反应进行相同时间后测得Ir作催化剂的CO2转化率α(CO2)较高,说明Ir的催化效率更高,所以,用Ir、Ce作催化剂时,反应的活化能降低更多的是Ir,故C错误;
800K时,反应进行相同时间后测得Ir作催化剂的CO2转化率α(CO2)较高,说明Ir的催化效率更高,所以,用Ir、Ce作催化剂时,反应的活化能降低更多的是Ir,故C错误;
D.状态d、e都是平衡状态,从d到e,该反应为放热反应,升温平衡逆向移动,α(CO2)减小,故D正确。
故答案选AC;
②列出三行式,
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
起始(mol) 4 7 0 0
转化(mol)4×50%=2 6 1 3
平衡(mol) 2 1 1 3
容器容积为10L,则CO2、H2、CH3OCH3、H2O的平衡浓度分别为0.2mol/L、0.1mol/L、0.1mol/L、0.3mol/L,
此时的平衡常数K=![]() =6.75×104。
=6.75×104。
故答案为:6.75×104;
(3)根据电池反应式可知,CH3OCH3在反应中被氧化,O2被还原,CH3OCH3在负极上反应,O2在正极上反应。又因为是碱性溶液不可能有H+参加或生成,故负极反应式为CH3OCH3 +16OH——12e—=2CO32-+11H2O,
故答案为:CH3OCH3 +16OH——12e—=2CO32-+11H2O;


科目:高中化学 来源: 题型:
【题目】将200mLH2SO4和Fe2(SO4)3的混合溶液分成两等份。向其中一份中加入足量铁粉,充分反应后测的固体质量减少4.48g;向另一份中加入足量BaCl2溶液,经过滤、洗涤、干燥、称量,得到46.6g白色沉淀。请计算:
(1)原溶液中c(SO42-)=______;
(2)原溶液中H2SO4和Fe2(SO4)3的物质的量浓度之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基乙酸(H2NCH2COOH)是蛋白质的水解产物之一,1 mol 的氨基乙酸中含有( )
A.2 mol氧气分子
B.12 mol氢原子
C.6.02×1023个H+
D.6.02×1023个氨基乙酸分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属冶炼的叙述中,不正确的是( )
A.电解铝时,以氧化铝—冰晶石熔融液为电解质,也常加入少量CaF2帮助降低熔点
B.电解铝时阴极碳块需定期更换
C.可利用铝热反应从V2O5中冶炼金属V
D.可用加热法从HgO中冶炼Hg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是
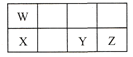
A.原子半径大小:X > Y > Z
B.W、Y两种元素都能与氧元素形成化合物WO2、YO2
C.氧化物对应水化物的酸性: Z > Y > W
D.Y能形成H2Y、H2YO4的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)下列说法正确是( )
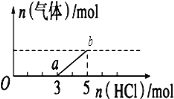
A.oa段反应的离子方程式为:H++OH-=H2O
B.O点溶液中所含溶质的化学式为NaHCO3、Na2CO3
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是合成一种新型抗肝炎药的中间体,其生产路线如下:
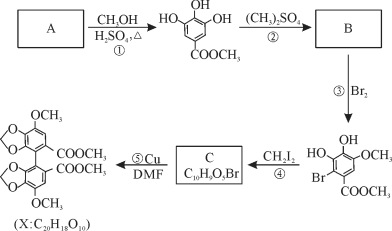
回答下列问题:
(1)反应①的反应类型为_____________。
(2)反应③的化学方程式为____________________________________________________。
(3)反应④生成C的结构简式为______________________,无机产物为_____(填化学式)。
(4)A有多种同分异构体,同时符合下列条件的有______种(不考虑立体异构)。请写出其中一种核磁共振氢谱有4组峰,且峰面积之比为2∶2∶1∶1的结构简式___________。
a.苯环上有4个取代基;
b.与FeCl3溶液发生显色反应;
c.能发生水解反应。
(5)参照上述合成路线及信息,以氯气、苯和一氯乙烯为原料(其它试剂任选),设计制备聚苯乙烯的合成路线____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.00gCuO和Fe2O3的混合物分成两等份,其中一份在高温下用足量CO还原后,剩余固体质量为2.88g;另一份固体用200mL某浓度的盐酸恰好溶解,则:
(1)混合物中CuO和Fe2O3的物质的量之比为:________________________
(2)所用盐酸的物质的量浓度为_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)和H2O(g)以1 : 2体积比分别通入到体积为2 L的恒容密闭容器中进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:

下列说法不正确的是
A. 从实验数据分析,该反应的正反应是吸热反应
B. 实验A中,在0~10min内,以v(H2)表示的反应速率大于0.013mol(L·min)-1
C. 从生产效益分析,C组实验的条件最佳
D. 比较实验B、C,说明C实验使用了更高效的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com