
分析 反应热=反应物键能之和-生成物中键能之和,利用化学计量数关系分析熵变,由此分析解答.
解答 解:N≡N的键能是946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为390.8kJ/mol,则N2(g)+3H2(g)?2NH3(g)△H=946kJ/mol+3×436kJ/mol-6×390.8kJ/mol=-90.8kJ/mol,该热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-90.8 kJ/mol,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-90.8kJ/mol.
点评 本题主要考查了反应热的计算、热化学方程式的书写,注意把握从键能的角度计算反应热的方法,注意热化学方程式:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,题目难度不大.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:填空题
 化学小组的同学利用如图所示装置进行实验.集气瓶中装有纯净物A,分液漏斗中盛有物质B.
化学小组的同学利用如图所示装置进行实验.集气瓶中装有纯净物A,分液漏斗中盛有物质B.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
 ,则氨气的平衡转化率是75%.
,则氨气的平衡转化率是75%.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的化学方程式及室温下的平衡常数如下:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的化学方程式及室温下的平衡常数如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一定量KAl(SO4)2溶液和一定量Ba(OH)2溶液混合,沉淀的质量恰好最大时:Al3++2SO42-+3OH-+2Ba2+=2BaSO4↓+Al(OH)3↓ | |
| B. | KMnO4与浓盐酸反应制Cl2:2MnO4-+16HCl=2Mn2++6Cl-+5Cl2↑+8H2O | |
| C. | 0.1molCl2和100mL1mol/LFeBr2反应:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 | |
| D. | 用Al(OH)3中和过多的胃酸:Al(OH)3+3H+=Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

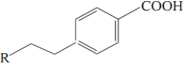
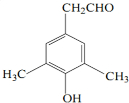
 ),M的一种合成路线如图(部分反应试剂和条件省略).
),M的一种合成路线如图(部分反应试剂和条件省略).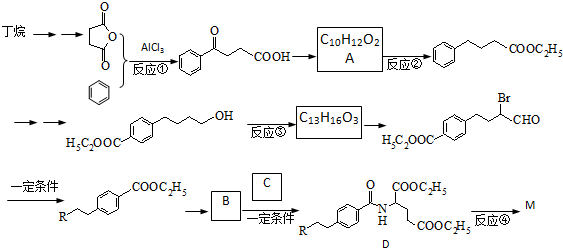
 ,C
,C ;
; 或
或
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z分别为H、C、N、O元素
W、X、Y、Z分别为H、C、N、O元素查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Cl2+Br2$\stackrel{光照}{→}$CHBrCl2+HBr | |
| B. | CH3OH+HCl→CH3Cl+H2O | |
| C. | CH3-CH2-Br+H2O$\stackrel{NaOH}{→}$CH3-CH2-OH+HBr | |
| D. | 2Na+2H2O═2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A2):c(B2):c(AB)=1:1:2 | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | 单位时间内生成n molA2的同时生成n mol B2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com