
在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.1 mol·L-1,c(Mg2+)=0.25 mol·L-1,c(Cl-)=0.2 mol·L-1,则c(SO42-)为
A.0.15 mol·L-1 B.0.10  mol·L-1 C.0.25 mol·L-1 D.0.20 mol·L-1
mol·L-1 C.0.25 mol·L-1 D.0.20 mol·L-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:实验题
Na2O2是常见的氧化钠,某化学小组的同学欲通过以下实验确定炭粉与Na2O2的反应产物。
【实验步骤】
Ⅰ.按如图所示装置(部分仪器未画出)组装仪器,并检查装置气密性。
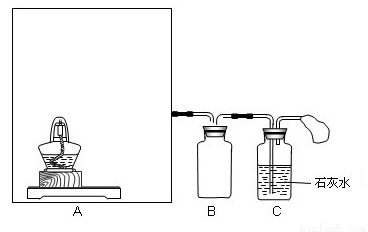
Ⅱ.将0.6g炭粉与3.9gNa2O2均匀混合,装入A装置中的反应容器,在靠近试管口处放置一张湿润的氯化钯试纸(湿润氯化钯试纸CO变黑,可用于检验是否有CO生成)。
Ⅲ.用酒精灯微微加热A装置中的反应容器
【实验现象】
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊。
回答下列问题:
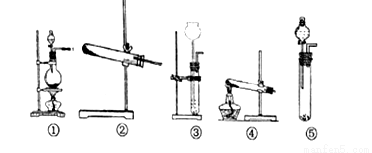
(1)在A装置中方框内的仪器可以选用_____________(①②③④⑤中选出所需的装置,使仪器装置图完整)。
(2)装置B的作用是________________。
(3)通过探究发现,装置A中只发生反应2Na2O2+C Na2CO3+X,则X为___________(填化学式)。
Na2CO3+X,则X为___________(填化学式)。
(4)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd),同时生成另外两种新物质.已知反应过程中转移6.02×1023个电子时,生成53g Pd,该反应的化学方程式为________________________。
(5)将装置A中完全反应后所得物质溶于适量水,配成溶液,回答下列问题:
①所得溶液的溶质是___________(填化学式)。
②常温,若使所得溶液与100 mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为___________。
(6)写出Na2O2的一种重要用途_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学试卷(解析版) 题型:选择题
下列关于分散系说法正确的是( )
A.胶体与溶液本质区别是有无丁达尔效应
B.均一稳定的分散系只有溶液
C.只有胶状物质如胶水、果冻才能称为胶体
D.一束平行光线照射Fe(OH)3胶体时,从侧面可以看到一条光亮通路
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆生产建设兵团二中高一上期中化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.32 g O2气体含有的氧原子数为NA
B.2 L 0.3 mol/L Na2SO4溶液中含有Na+为0.6NA
C.54 g铝完全反应后失去的电子数为6NA
D.11.2 L氮气所含的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆生产建设兵团二中高一上期中化学卷(解析版) 题型:选择题
下列各组物质,按化合物、单质、混合物的顺序排列的是
A.烧碱、液态氧、碘酒 B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢 D.空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆生产建设兵团二中高一上期中化学卷(解析版) 题型:选择题
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无 气泡产生;⑤过滤。下列操作顺序合理的是
气泡产生;⑤过滤。下列操作顺序合理的是
A.③①②④⑤ B.②①③⑤④ C.①②③⑤④ D.③②①⑤④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏林芝一中高一上期中化学试卷(解析版) 题型:选择题
若以w1和w2分别表示物质的量是浓度为c1 mol/L和c2 mol/L氨水溶液的质量分数,已知2w1=w2,且氨水的密度小于纯水的密度,则下列推断正确的是( )
A.2c1=c2 B.2c2=c1 C.c2>2c1 D.c1<c2<2c1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
质量分数为a%,物质的量浓度为cmol·L-1的NaCl溶液,蒸发溶剂,恢复到原来的温度,若物质的量浓度变为2cmol·L-1,则质量分数变为(蒸发过程中没有晶体析出)
A.等于2a% B.大于2a% C.小于2a% D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省洛阳市高一上学期期中化学试卷(解析版) 题型:实验题
实验室用密度为1.25 g • mL-1、质量分数为36.5%的浓盐酸配制240 mL 0.1 mol • L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为 。
(2)配制 240 mL 0.1 mol • L-1的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
|
|
(1)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30 mL水洗涤烧杯内壁和玻璃棒2〜3次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30 mL), 用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1〜2 cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤, 。
②容量瓶中原有少量蒸馏水, 。
③定容时观察液面俯视, 。
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度 。
②向容量瓶中转移溶液时有滚液不慎有溶液溅出 。
③定容摇勻后发现液面下降 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com