
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl(浓)===2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________(填序号)。
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为________mol。
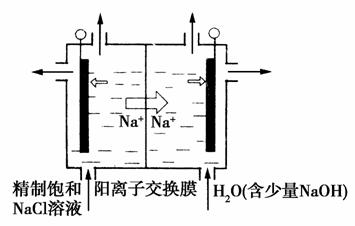
(2)目前已开发出用电解法制取ClO2的新工艺。
①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:__________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_______
mol,用平衡移动原理解释阴极区pH增大的原因_________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mol·L-1,现用ClO2将CN-氧化,有两种气体生成,其离子反应方程式为__________________。
解析:本题考查了氧化还原反应和电化学知识,意在考查考生的综合分析能力和应用能力。(1)①该反应中,浓盐酸中一部分-1价的氯元素被氧化为0价,此部分HCl作还原剂;另一部分留在“NaCl”中,此部分HCl起到酸的作用。②该反应转移2个电子,若产生0.1 mol ClO2,则转移0.1 mol电子。(2)①电解池的阳极发生氧化反应,Cl-失去电子生成ClO2,根据元素守恒可知反应物中有水,生成物中含有H+。②阴极的电极反应式为2H++2e-===H2↑,据此电极反应式可知,生成112 mL H2,转移0.01 mol电子,消耗0.01 mol H+,由溶液呈电中性可知,通过阳离子交换膜的阳离子是0.01 mol,阴极溶液的pH增大,可由H+放电使水的电离平衡正向移动来解释。(3)根据信息分析,两种气体是N2和CO2,ClO2的还原产物是Cl-,然后配平即可。
答案:(1)①B(1分) ②0.1(1分)
(2)①Cl--5e-+2H2O===ClO2↑+4H+(2分)
②0.01(2分)在阴极发生2H++2e-===H2↑,H+浓度减小,使得H2OOH-+H+的平衡向右移动,OH-浓度增大,pH增大(2分)
(3)2ClO2+2CN-===N2+2CO2+2Cl-(2分)


科目:高中化学 来源: 题型:
X、Y、Z、W有右图所示的转化关系,已知焓变:
ΔH=ΔH1+ΔH2,则X、Y可能是
①C、CO ②Na2CO3、NaHCO3 ③AlCl3、Al(OH)3 ④FeBr2、FeBr3
A.①②③④ B.①③ C.②④ D.①②③

查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
| X | Y | ||
| Z | W |
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
| A | B | C | D |
|
|
|
|
|
| 闪电时会发生反应:N2+O2 | 利用丁达尔效应证明烧杯中的分散系是胶体 | 蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 | 加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙是三种不含相同离子的可溶性电解质。它们所含的离子如下表所示
| 阳离子 | NH |
| 阴离子 | OH-、NO |
取等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)>c(乙)>c(丙),下列说法错误的是( )
A.甲中一定含Na+ B.乙中一定含NH
C.丙中一定含Mg2+ D.丙中一定含SO
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题。
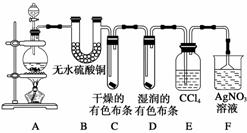
(1)装置B、E的作用分别为________,________。
(2)装置C、D的作用分别为________,________。
(3)装置F中AgNO3溶液的作用是________,倒置漏斗的作用是________。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间加一个装置。你认为该装置加在__________与________之间(填装置各部分字母),装置中应放入________,作用是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于卤素的叙述正确的是 ( )
①卤素的钾盐中,最易被氧化的是氟化钾 ②溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯 ③溴化银具有感光性,碘化银不具有感光性 ④某溶液与淀粉KI溶液反应出现蓝色,则证明该溶液是氯水或溴水 ⑤氟气跟氯化钠水溶液反应,一定有氟化氢和氧气生成 ⑥氯气跟水反应时,水既不是氧化剂也不是还原剂
A.①③⑤ B.②③⑥
C.②⑤⑥ D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com