
| A. | 质子数:c>b | B. | 离子的还原性:Y2-<Z- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 粒子半径:cY2->dZ->bX+>aW3+ |
分析 短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则有a-3=b-1=c+2=d+1,可知原子序数a>b>d>c,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素,结合元素周期律解答.
解答 解:短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则有a-3=b-1=c+2=d+1,可知原子序数a>b>d>c,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素.
A.由以上分析可知c=8,b=11,则质子数c<b,故A错误;
B.非金属性F>O,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性Y2->Z-,故B错误;
C.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为HZ>H2Y,故C错误;
D.电子层结构相同的离子原子序数越大、离子半径越小,则粒子半径:cY2->dZ->bX+>aW3+,故D正确,
故选D.
点评 本题考查结构与位置关系、元素周期律等,难度中等,根据电荷与核外电子排布相同推断元素在周期表中的位置是关键,侧重于考查学生的分析能力和应用能力.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:解答题
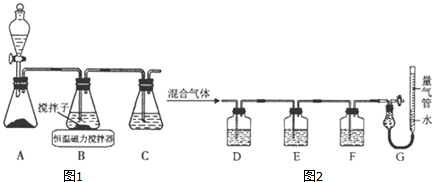
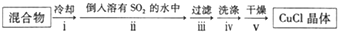
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 硫在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
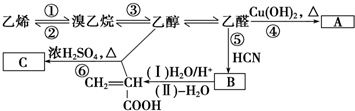
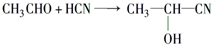 ;加成反应.
;加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
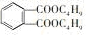 ),过量摄入塑化剂会对肝肾功能造成影响,甚至诱发癌症.下列有关说法正确的是( )
),过量摄入塑化剂会对肝肾功能造成影响,甚至诱发癌症.下列有关说法正确的是( )| A. | DBP的分子式为C16H22O4 | |
| B. | 1mol DBP可以与5molH2反应 | |
| C. | 1mol DBP在碱性条件下水解时消耗4molNaOH | |
| D. | DBP所有原子在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn-2e-=Zn2+ | B. | Br2+2e-=2Br- | C. | 2Br--2e-=Br2 | D. | Zn2++2e-=Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数 | |
| B. | 在金刚石晶体中,围成最小环的原子数 | |
| C. | 在二氧化硅晶体中,围成最小环的硅原子数 | |
| D. | 在CsCl晶体中,与一个Cs+最近的且距离相等的Cl-的个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
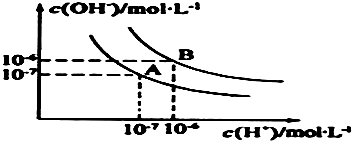 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com