
【题目】在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
A.达到平衡时SO2的转化率约为33.3%
B.达到平衡时反应放出的热量为294.9 kJ
C.平衡时SO3的物质的量为2mol
D.达平衡时用O2表示的反应速率为0.25 mol·L-1·min-1
【答案】A
【解析】
设SO2的转化率为x,根据三段式可知,
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1
开始时的量(mol) 3 2 0
改变的量(mol) 3x 1.5x 3x
平衡时的量(mol) 3-3x 2-1.5x 3x
平衡时容器内气体总的物质的量为起始时的90%,则3-3x+(2-1.5x)+3x=(3+2)×90%,解得x=33.3%,3x=1;
A. 达到平衡时SO2的转化率约为33.3%,选项A正确;
B. 达到平衡时反应放出的热量为196.6 kJ ×3x =196.6 kJ,选项B错误;
C. 平衡时SO3的物质的量为3x mol =1mol,选项C错误;
D. 条件不足,无法计算平衡时反应容器的体积,无法计算化学反应速率,选项D错误。
答案选A。


科目:高中化学 来源: 题型:
【题目】在105℃时1L两种气态混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积为10.5L,再将气体通过碱石灰,体积缩小6L。则下列各组混合烃中符合此条件的是
A.CH4,C2H6B.C2H4,C3H8C.C2H4,C3H6D.C2H2,C4H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是
A. 钠和冷水反应:Na+2H2O=Na++2OH﹣+H2↑
B. 用小苏打治疗胃酸过多:![]() +H+=CO2↑+H2O
+H+=CO2↑+H2O
C. 氯化铝溶液中加入过量氨水:Al3++3OH﹣=Al(OH)3↓
D. 三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝并测定氢氧化铝的纯度,设计的主要流程如下:

已知:Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7。
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式___,试剂X的名称为__。
(2)加入Z的作用是调节溶液的pH,pH范围应为___;下列可作为试剂z的是___。
a.铜粉 b.氨水 c.氧化铜 d.硫酸铜
(3)实验操作①依次是____、___,过滤洗涤即可得到硝酸铜晶体。
(4)根据流程图内数据计算:滤渣C中氢氧化铝的质量分数为___。(用m、n的代数式表示)
(5)按该流程的操作步骤,氢氧化铝质量分数的测定结果可能性是非常大的,原因有①___;②____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,观察到灵敏电流计指针偏转,图中a、b电极均为铜单质,下列说法正确的是( )
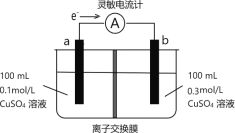
A.该装置的能量转换形式为:电能→化学能
B.b的电极反应为:Cu-2e-=Cu2+
C.溶液中SO![]() 穿过阴离子交换膜发生迁移
穿过阴离子交换膜发生迁移
D.外电路转移的电子最多为0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.10mol·L-1一元弱酸HA(Ka=10-3)中逐滴加入0.10mol·L-1的NaOH溶液,溶液pH随所加NaOH溶液体积变化如图。下列说法不正确的是( )
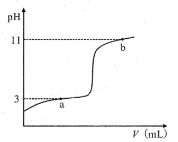
A.a点处存在c(HA)+c(OH-)=c(Na+)+c(H+)
B.b点处存在c(Na+)=c(HA)+c(OH-)+c(A-)
C.由a→b,溶液中n(A-)持续增大
D.V=10mL时,存在c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的反应热下划线处表示燃烧热的是 ( )
A.NH3(g) +![]() O2(g) = NO(g) +
O2(g) = NO(g) +![]() H2O(g) ΔH=-a kJ·mol-1
H2O(g) ΔH=-a kJ·mol-1
B.C6H12O6(s) + 6O2(g) = 6CO2(g) + 6H2O(g) ΔH=-b kJ·mol-1
C.CO(g) +![]() O2(g) = CO2(g) ΔH=-c kJ·mol-1
O2(g) = CO2(g) ΔH=-c kJ·mol-1
D.CH3CH2OH(l) +![]() O2(g) = CH3CHO(l) + H2O(l) ΔH=-d kJ·mol-1
O2(g) = CH3CHO(l) + H2O(l) ΔH=-d kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL某浓度的稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 0 | 50 | 120 | 232 | 290 | 310 |
(1)2~3min段的反应速率比1~2min段的反应速率__________(填“块”或“慢”),原因是______;
(2)求2~3min段以HCl的浓度变化来表示的平均反应速率(设溶液体积不变)____________;
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号)____________。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaS在环境保护、制备电致发光材料等方面用途非常广泛。回答下列问题:
(1)制取CaS的反应如下:
反应(I):CaSO4(s)+2C(s)![]() CaS(s)+2CO2(g) △H1
CaS(s)+2CO2(g) △H1
反应(II):CaCO3(s)+H2S(g)![]() CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
①若在恒温恒容密闭容器中只发生反应(I),达到平衡时向容器中通入少量CO2,则反应再次达到平衡时c(CO2)将___(填“增大”“减小”或“不变”)。
②已知下列热化学方程式:.
i:S2(g)+CaSO4(s)![]() CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
ii:2SO2(g)+4CO(g)=S2(g)+4CO2(g) △H=+16.0kJ·mol-1
iii:C(s)+CO2(g)=2CO(g) △H=+172.5kJ·mol-1
则反应(I)的△H1=___kJ·mol-1。
③反应(II)的△S___(填“>”“<”或“=”)0。若反应(II)在恒温恒容密闭容器中进行,能说明该反应已达到平衡状态的是___(填字母)。
A.v(H2O)正=v(CO2)正
B.容器中气体总压强不再随时间变化
C.容器中同时存在H2S(g)、CO2(g)和H2O(g)
D.单位时间内断裂H-S键与断裂C=O键数目相等
(2)CaS能被许多物质氧化,有关反应的lgKp与温度关系如图(Kp为以分压表示的平衡常数;分压=总压×物质的量分数;图中数据由压强单位为kPa得出)。
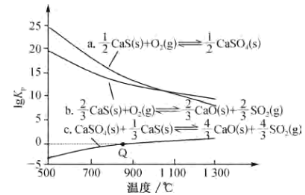
①属于吸热反应的是___ (填“a”“b”或“c”)。
②相同温度下,反应a、b、c的lgKp(a)、lgKp(b)、lgKp(c)之间满足的关系是lgKp(c)=___。
③反应c在Q点时:p(SO2)=___kPa,以浓度表示的平衡常数Kc=___Kp[用R、T表示;已知气体的压强、体积、温度满足pV=nRT(n为气体的物质的量,R为恒量)]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com