
����Ŀ���ߴ����������й㷺����;��ij�о�С��������������ȡ�ߴ�����������
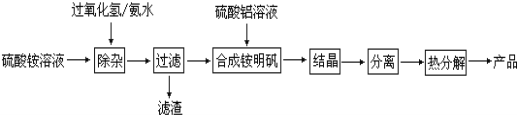
������������ͼ��գ�
��1�������ӡ��������ȼ�����������ַ�Ӧ�����ð�ˮ������Һ��pH��ʹ�������Һ�е�����Fe2+����ΪFe3+����һ��ת��ΪFe(OH)3�Ӷ���ȥFe2+����Fe2+��������������ΪFe3+�����ӷ���ʽΪ: ��
��2��������������Һʱ�����������ữ���ữ��Ŀ���� ��
��3�������롱������������ (����ĸ����)��
A������ B����Һ C������
��4�����������Ļ�ѧʽΪNH4Al(SO4)212H2O����������� (����������)��0.1mol/L�������ˮ��Һ�У�Ũ������������ ��
��5���ȷֽ��з������·�Ӧ6NH4Al(SO4)2 = 3Al2O3 + 2NH3 ��+ 2N2 ��+ 6SO2 ��+ 6SO3 ��+ 9H2O��������1mol Al2O3ʱת�Ƶ������ʵ���Ϊ mol��
��6������0.1mol�����ϡ��Һ����μ��뺬0.3mol Ba(OH)2��ϡ��Һ����Ӧ�������ӷ���ʽΪ: ��
���𰸡���1��2Fe2+ +H2O2 +2H+=2Fe3++2H2O ��2������Al3+ˮ��(���ֹˮ�ⲻ����) ��3��C
��4�������� SO42- ��5�� 4 ��6�� NH4++Al3++2SO42-+2Ba2++5OH- =NH3��H2O+AlO2-+2BaSO4��+2H2O
��������
�����������1���������Ӿ��л�ԭ����˫��ˮ����ǿ����������������Һ�����������ӱ������������������˷�Ӧ�����ӷ�Ӧ����ʽΪ2Fe2+ +H2O2 +2H+=2Fe3++2H2O��
��2����������������Һ���ܹ�����ˮ�������������������Լ��������ữ�������������ӵ�ˮ�⣻
��3��ͨ�����ˣ����������������Һ�з��룬����C��ȷ��
��4�����������Ļ�ѧʽΪNH4Al(SO4)212H2O���������0.1mol/L�������ˮ��Һ�У�δˮ��ǰ��c(Al3+)=c(NH4+)=0.1mol/L������笠��������Ӿ�ˮ�⣬ˮ����ˮ�����������������ˮ���Ũ�Ⱦ�С��0.1mol/L��c(SO42-)=0.2mol/L����Һ��������ΪSO42-��
��5������Ӧ6NH4Al(SO4)2 = 3Al2O3 + 2NH3 ��+ 2N2 ��+ 6SO2 ��+ 6SO3 ��+ 9H2O��N2���������ÿ����2molN2ת��12mol���ӣ�ͬʱ�õ�3molAl2O3����������1mol Al2O3ʱת�Ƶ������ʵ���Ϊ12mol��3=4mol��
��6������0.1mol�����ϡ��Һ����μ��뺬0.3mol Ba(OH)2��ϡ��Һ��������Ӧ�������ӷ���ʽΪ NH4++Al3++2SO42-+2Ba2++5OH- =NH3��H2O+AlO2-+2BaSO4��+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��R��Q��M�����ֶ�����Ԫ�أ�ԭ��������������X��ԭ�Ӱ뾶��С��Ԫ�أ�Y����̬�⻯����ʹʪ��ĺ�ɫʯ����ֽ������ZΪ�ؿ��к�������Ԫ�أ�R��Xͬ���壻Y��R��Q����������֮��Ϊ8��M�ĵ��ʻ���ɫ�к����塣��ش��������⣺
(1)R��Ԫ�����ڱ��е�λ��Ϊ___________��
(2)Z��Q��M�����Ӱ뾶�ɴ�С��˳��Ϊ(дԪ�����ӷ���)___________��
(3)X��Y��Z����Ԫ���γ���������ˮ��Һ�����Ե�ԭ��(�����ӷ���ʽ��ʾ)________________��
��Һ����������Ũ���ɴ�С��˳��Ϊ________________��
(4)YX4M�ĵ���ʽΪ___________��Q3Y2��ˮ�ɾ��ҷ�Ӧ���������������壬��Ӧ�Ļ�ѧ����ʽΪ
____________________��
(5)X��Z��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ������к��еĻ�ѧ������Ϊ_______________________��
(6)M�ĵ�����R������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������пƬ�ʹ�ͭƬ��ͼ��ʽ����ͬŨ�ȵ�ϡ������һ��ʱ�䣬����������ȷ����
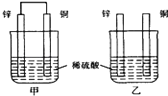
A. ���ձ���ͭƬ����������ݲ���
B. ����ͭƬ������������ͭƬ�Ǹ���
C. ���ձ�����Һ��pH������
D. �ס�����Һ������ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ṹ�У������ڵ�˫������ṹ��������Ϊ֤�ݵ���ʵ��
��������ʹ����KMnO4��Һ��ɫ��
������̼̼���ļ�������ȣ�
��������һ�������¸�H2�ӳ����ɻ����飻
����ʵ�����ڶ��ױ�(![]() )��һ�ֽṹ��
)��һ�ֽṹ��
������FeBr3���ڵ�������ͬҺ��ɷ���ȡ����Ӧ����������ѧ�仯��ʹ��ˮ��ɫ��
A. �ۢܢ� B. �٢ۢ� . C. �٢ڢܢ� D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E����ѧ��ѧ�������ʣ� X��Y��Z��M��N��W��H��K�dz��������X��B��C�Ļ��ϲ������֮��������ת����ϵ����Ӧ��Ͳ����е�H2O����ȥ����


��1��Y�ĵ���ʽΪ ������C���ʵ�Ԫ�������ڱ���λ��
��2����Ӧ�������ӷ���ʽΪ ��Ӧ�������ӷ���ʽΪ
��3��ij������B��Ư�ۡ�
��д����Ư�۵Ļ�ѧ����ʽ
��Ϊ�ⶨ�ù����Ƶõ�Ư������Ч�ɷֵĺ�����ijС�����������ʵ�飺��ȡƯ��2.0g����ĥ���ܽ⣬������250mL��Һ��ȡ��25.00mL���뵽��ƿ�У��ټ��������KI��Һ��������������ʱ���������ӷ���ʽΪ�� ���á�����ȫ��Ӧ����0.1mol��L-1��Na2S2O3��Һ������Һ�ζ���Ӧ���ɵĵ⣬��֪��ӦʽΪ��2Na2S2O3+I2=Na2S4O6+2NaI������ȥNa2S2O3��Һ20.00mL�����Ư������Ч�ɷ�����������Ϊ ��������С�������λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л���������ԭ����������ȷ����
A��̼ԭ�����ʻ��ã������γɻ�����
B��̼ԭ�Ӽ����Թ��ۼ��γ�̼����̼��
C��̼ԭ��֮�����γɵ�����Ҳ���γ�˫��������
D��̼ԭ�ӳ��˱˴˼���Գɼ��⣬������������Ԫ�ص�ԭ�ӳɼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����𱽷���Һ����ϩ�ͼױ�����ѡ�õ�����Լ���
A����ˮ B��FeCl3��Һ
C������Cu(OH)2����Һ D������KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Cu��Fe2O3�Ļ�����м���100mL 1molL��1�����ᣬǡ��ʹ�������ȫ�ܽ⣬������Һ�в���Fe3+�����ù�����CO�ڸ����»�ԭ��ͬ������ԭ����������ٵ�����Ϊ
A��3.2 g B�� 2.4 g C��1.6 g D��0.8 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NH4��2SO4��һ�������·������·�Ӧ��4��NH4��2SO4 �� N2�� �� 6NH3�� �� 3SO2�� �� SO3�� �� 7H2O������Ӧ��Ļ��������ͨ��Ũ���ᣬ��ͨ��������BaCl2��Һ�����Ϊ
A������BaSO3���� B������BaSO4����
C������BaSO4��BaSO3���� D����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com