

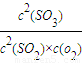 =
=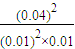 =1.6×103,故答案为:1.6×103;
=1.6×103,故答案为:1.6×103;

科目:高中化学 来源: 题型:阅读理解
 (2010?祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.
(2010?祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.查看答案和解析>>
科目:高中化学 来源: 题型:
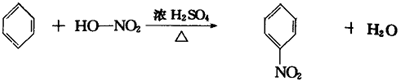
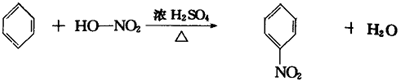


 7CO2+4H2O
7CO2+4H2O 7CO2+4H2O
7CO2+4H2O| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
阅读材料,回答问题.
(1)常用的大气污染分为一次污染和二次污染.二次污染指的是排人环境中的一次污染物在物理、化学因素或生物作用下发生变化,或与环境中的其他物质发生反应生成新的污染物,如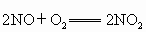 ,则二氧化氮就是二次污染物,由二氧化氮导致的污染就是一氧化氮的二次污染.有下列物质:①
,则二氧化氮就是二次污染物,由二氧化氮导致的污染就是一氧化氮的二次污染.有下列物质:①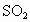 ;②NO;③
;②NO;③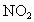 ;④HCl;⑤CO.其不会导致二次污染的是___________.
;④HCl;⑤CO.其不会导致二次污染的是___________.
(2)汽车尾气(含一氧化碳、二氧化硫和一氧化氮等)是城市空气的污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体,并促进二氧化硫的转化.
①汽车尾气中污染空气的主要物质是____________________________.
②写出一氧化碳与一氧化氮反应的化学方程式:__________________.
③使用“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是_______________________________________________________.
④控制城市空气污染源的方法有
[ ]
查看答案和解析>>
科目:高中化学 来源: 题型:022
阅读材料,回答问题.
(1)常用的大气污染分为一次污染和二次污染.二次污染指的是排人环境中的一次污染物在物理、化学因素或生物作用下发生变化,或与环境中的其他物质发生反应生成新的污染物,如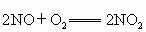 ,则二氧化氮就是二次污染物,由二氧化氮导致的污染就是一氧化氮的二次污染.有下列物质:①
,则二氧化氮就是二次污染物,由二氧化氮导致的污染就是一氧化氮的二次污染.有下列物质:①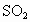 ;②NO;③
;②NO;③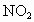 ;④HCl;⑤CO.其不会导致二次污染的是___________.
;④HCl;⑤CO.其不会导致二次污染的是___________.
(2)汽车尾气(含一氧化碳、二氧化硫和一氧化氮等)是城市空气的污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体,并促进二氧化硫的转化.
①汽车尾气中污染空气的主要物质是____________________________.
②写出一氧化碳与一氧化氮反应的化学方程式:__________________.
③使用“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是_______________________________________________________.
④控制城市空气污染源的方法有
[ ]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com