
| A. | 在炭粉燃烧中加入KClO3 | |
| B. | Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸 | |
| C. | 在K2S04与BaCl2两溶液反应时,增大压强 | |
| D. | Na与乙醇反应时增大乙醇的用量 |
分析 增大反应物的浓度、接触面积可增大反应速率,对于纯液体改变用量反应速率不变,对于没有气体参加的反应,增大压强反应速率不变,注意浓硫酸的性质,以此来解答.
解答 解:A.在炭粉燃烧中加入KClO3,KClO3分解生成氧气,氧气浓度增大,则反应速率增大,故A正确;
B.浓硫酸与锌反应不生成氢气,生成二氧化硫气体,故B错误;
C.对于溶液中的反应,增大压强,浓度基本不变,反应速率不变,故C错误;
D.增加乙醇,浓度不变,反应速率不变,故D错误.
故选A.
点评 本题考查影响化学反应速率的因素,把握浓度、接触面积对反应速率的影响为解答的关键,注重基础知识的考查,题目难度不大,选项B为易错点.


科目:高中化学 来源: 题型:填空题
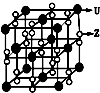 X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CI | B. | CH2=CH-CH=CH2 | C. | CH3-CH=CH2 | D. | 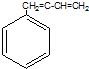 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若在恒温恒压下,当x=1时按1.5 mol A、1molC作为起始物质,平衡后C的体积分数仍为a | |
| B. | 若在恒温恒容下,当x=2时将2molC作起始物质,平衡后C的体积分数仍为a | |
| C. | 若在恒温恒压下,当x=3时1mol A、1mol B、6molC作起始物质,平衡后C的体积分数仍为a | |
| D. | 若在恒温恒容下,按0.6mol A、0.3mol B、1.4molC作起始物质,平衡后C的体积分数仍为a,则x只能等于2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mol/LHCl | B. | 4mol/LHNO3 | C. | 8mol/LNaOH | D. | 18mol/LH2SO4 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2 、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是
A.2SO3(g) 2SO2(g)+O2(g);△H =+196.6 kJ/mol
2SO2(g)+O2(g);△H =+196.6 kJ/mol
B.2SO2(g)+O2(g) SO3(g);△H =-98.3 kJ/mol
SO3(g);△H =-98.3 kJ/mol
C.SO2(g)+1/2O2(g) SO3(g);△H=+98.3 kJ/mol
SO3(g);△H=+98.3 kJ/mol
D.SO2(g)+1/2O2(g) SO3(g);△H=-196.6 kJ/mol
SO3(g);△H=-196.6 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com