
实验:①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是( )
A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
科目:高中化学 来源: 题型:
(1)分析如图所示的四个装置,请回答下列问题:

①装置a和b中铝电极上的电极反应式分别为___________________、_______________。
②装置c中产生气泡的电极为________电极(填“铁”或“铜”),装置d中铜电极上的电极反应式为__________________________________。
(2)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为_____________________________、__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并积极采取措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是__________(填字母)。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫化物沉降 | 化学法 |
| C | 含纯碱的废水 | 加石灰水反应 | 化学法 |
(2)下图是某市污水处理的工艺流程示意图:
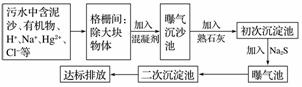
①下列物质中不可以作为混凝剂(沉降剂)使用的是____(填字母)。
A.偏铝酸钠 B.氧化铝
C.碱式氯化铝 D.氯化铁
②混凝剂除去悬浮物质的过程是________(填字母)。
A.物理变化 B.化学变化
C.既有物理变化又有化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
根据题目提供的溶度积数据进行计算并回答下列问题:
(1)已知25 ℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25 ℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________。
(2)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________。
②完全沉淀后,溶液的pH=__________。
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成?____________(填“是”或“否”)。
(3)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:____________。
(2)[2012·浙江理综,26(1)]已知:I2+2S2O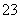 ===S4O
===S4O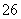 +2I-
+2I-
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入__________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=______________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验:①0.1 mol·L-1MgCl2溶液和0.2 mol·L-1NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;②向浊液a中滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀。下列分析不正确的是( )
A滤液b的pH=7
B.②中颜色变化说明Mg(OH)2转化为Fe(OH)3
C.实验可以证明Fe(OH)3的溶解度比Mg(OH)2的小
D.浊液a中存在沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
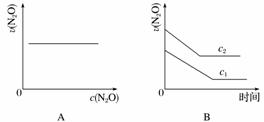
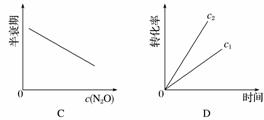
在一定条件下,N2O分解的部分实验数据如下:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O)/mol·L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间/min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O)/mol·L-1 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com