
| A. | c(CN-)<c(HCN) | B. | c(HCN)+c(CN-)═0.04 mol/L | ||
| C. | c(OH-)═c(H+)+c(HCN) | D. | c(Na+)>c(CN-)>c(H+)>c(OH-) |
分析 0.02mol/L HCN溶液与0.02mol/L NaCN溶液等体积混合,混合溶液c(CN-)<c(Na+),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CN-)+c(OH-),因为c(CN-)<c(Na+),所以得c(H+)<c(OH-),溶液呈碱性,说明NaCN水解程度大于HCN电离程度,据此分析解答.
解答 解:0.02mol/L HCN溶液与0.02mol/L NaCN溶液等体积混合,混合溶液c(CN-)<c(Na+),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CN-)+c(OH-),因为c(CN-)<c(Na+),所以得c(H+)<c(OH-),溶液呈碱性,说明NaCN水解程度大于HCN电离程度,
A.NaCN水解程度大于HCN电离程度,结合物料守恒知,c(CN-)<c(HCN),故A正确;
B.二者等体积混合时溶液体积增大一倍,浓度降为原来的一半,结合物料守恒得c(HCN)+c(CN-)═0.02 mol/L,故B错误;
C.根据电荷守恒得c(Na+)+c(H+)=c(CN-)+c(OH-),根据物料守恒得2c(Na+)=c(CN-)+c(HCN),所以得c(HCN)+2c(H+)=c(CN-)+2c(OH-),故C错误;
D.通过以上分析知,溶液呈碱性,则c(H+)<c(OH-),故D错误;
故选A.
点评 本题以盐类水解、弱电解质的电离为载体考查离子浓度大小比较,为高频考点,正确判断溶液酸碱性是解本题关键,注意电荷守恒、物料守恒的灵活运用,题目难度不大.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 | |
| B. | 达到平衡时,O2的转化率是31.5% | |
| C. | 达到平衡时,SO2的转化率是31.5% | |
| D. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ⑤聚乙烯 ⑥
⑤聚乙烯 ⑥

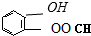 、
、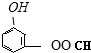 、
、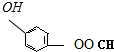
 ,聚乙二酸乙二酯H0
,聚乙二酸乙二酯H0 OCOCOOCH2CH2
OCOCOOCH2CH2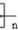 OH.
OH.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
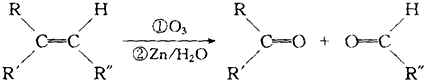
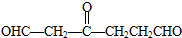 ,则该烯烃的结构不可能是( )
,则该烯烃的结构不可能是( )| A. | 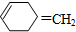 | B. | 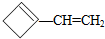 | C. | 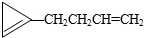 | D. | 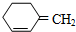 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
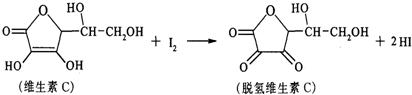
| A. | 上述反应为取代反应 | |
| B. | 维生素C能使高锰酸钾酸性溶液褪色 | |
| C. | 维生素C不溶于水,可溶于有机溶剂 | |
| D. | 维生素C的分子式为C6H10O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com