
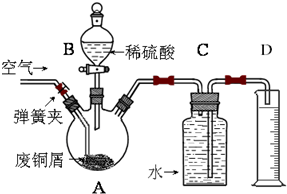
某探究小组采用下图所示装置进行Fe粉与水蒸气的反应。

(1)实验前检查装置气密性的方法为________________________________________________________。
(2)检验实验中生成气体的实验操作是_____________________________________________。
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用酒精喷灯、乙组用酒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
|
步骤 |
操作 |
甲组现象 |
乙组现象 |
|
1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,无气泡 |
|
2 |
取步骤1中溶液,滴加酸性KMnO4溶液 |
紫色褪去 |
紫色褪去 |
|
3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
|
4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因是 ;验证方法为 。
(1)将装置末端的导管插入盛有水的水槽中,双手捂住试管,导管口有气泡冒出,松开双手,导管内有一段水柱,则装置气密性良好;(2)点燃肥皂泡,有爆鸣声 (3)①FeO②Fe3O4+8H+=2Fe3++ Fe2+ +4H2O ③氯气将Fe2+氧化成Fe3+,Fe3+与SCN-反应溶液呈红色 SCN-被过量氯气氧化 ;向溶液中再加入KSCN溶液,溶液呈红色则说明之前SCN-被过量氯气氧化。
【解析】
试题分析:(1)实验前检查装置气密性的方法为:将装置末端的导管插入盛有水的水槽中,双手捂住试管,导管口有气泡冒出,松开双手,导管内有一段水柱,则装置气密性良好;(2)实验所得的气体为氢气,检验氢气的实验操作是点燃肥皂泡,有爆鸣声;(3)实验所得的物质为FeO或Fe3O4,由于像乙实验所得的溶液中滴加KSCN溶液,无现象,故乙实验中所得的物质为FeO,甲实验中所得的物质为Fe3O4,故①乙组得到的黑色粉末是FeO②Fe3O4与稀盐酸反应的化学方程式为:Fe3O4+8H+=2Fe3++ Fe2+ +4H2O;③乙组步骤4中,溶液变红的原因为氯气将Fe2+氧化成Fe3+,Fe3+与SCN-反应溶液呈红色 ;SCN-被过量氯气氧化;向溶液中再加入KSCN溶液,溶液呈红色则说明之前SCN-被过量氯气氧化。
考点:探究实验,铁与水蒸气的反应。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
碳酸钠与工农业生产、日常生活紧密相关。工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀________(填操作)、洗涤、烘干、称量。洗涤沉淀的操作是 ______________________________ 。
方案二:气体分析法
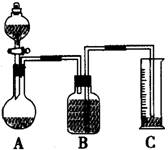
(2)把一定量的样品与足量盐酸反应后,用下图装置测定产生CO2气体的体积,为了测量结果准确,B中的溶液最好采用___________________,但选用该溶液后实验结果仍然不够准确,其原因是_______________________。
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用下图所示装置,通过称量反应前后盛有碱石灰的干燥管质量,利用其质量差求算样品的纯度。
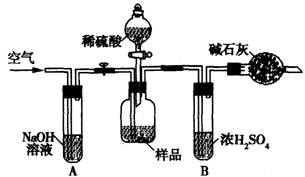
该实验的操作步骤有:①在干燥管内填满碱石灰,质量为mg ②取ng样品装入广口瓶中
③检验装置的气密性 ④缓慢鼓人空气数分钟,再称量干燥管质量为Mg ⑤关闭止水夹
⑥打开止水夹 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓人空气数分钟
Ⅰ.正确的操作顺序是(填写序号):③→_________→⑥→______⑤→________⑦→______
Ⅱ.在操作④中,要缓慢鼓人空气数分钟,鼓人空气的作用是_________ ;装置A的作用是 _________;装置B的作用是 _____________。
Ⅲ.若去掉装置A,测定结果______________ ;若去掉装置B,测定结果_________ (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:山东省模拟题 题型:实验题


查看答案和解析>>
科目:高中化学 来源:2012年北京市房山区高考化学二模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com