
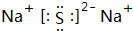 ,
,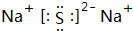 ;
;| 1 |
| 2 |
| 2 |
| 3 |
| 2 |
| 3 |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加入足量Na2CO3溶液 |
| 操作甲 |
| 加入足量A |
| 加热 |
| 趁热过滤 |
| 结晶操作 |
| 控制酸度 |
| FeSO4?7H2O |
| 晶体 |
| 温度/ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/ | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | |||||||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用如图电解实验可以制得白色的纯净的Fe(OH)2沉淀.两电极材料分别为石墨和铁.
由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用如图电解实验可以制得白色的纯净的Fe(OH)2沉淀.两电极材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a是锌,b是铜,c是稀硫酸溶液 |
| B、a是铁,b是银,c是硝酸银溶液 |
| C、a是银,b是铁,c是硝酸银溶液 |
| D、a是碳,b是铁,c是氯化铜溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com