
某离子化合物的晶体中,最小重复单元及其八分之一结构单元如图所示,具有该晶体结构的化合物可能是( )
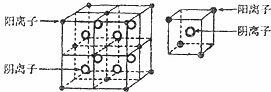
|
| A. | CaF2 | B. | CO2 | C. | NaCl | D. | CsCl |
考点:
晶胞的计算.
分析:
阴离子位于晶胞的体内,共8个,阳离子位于晶胞的顶点和面心,晶胞中B的个数为8×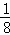 +6×
+6×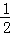 =4,则阳离子与阴离子的离子个数为4:8=1:2,结合选项中各物质阳离子与阴离子数目之比判断.
=4,则阳离子与阴离子的离子个数为4:8=1:2,结合选项中各物质阳离子与阴离子数目之比判断.
解答:
解:阴离子位于晶胞的体内,共8个,阳离子位于晶胞的顶点和面心,晶胞中B的个数为8×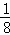 +6×
+6×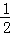 =4,则阳离子与阴离子的离子个数为4:8=1:2,
=4,则阳离子与阴离子的离子个数为4:8=1:2,
A.CaF2由钙离子与氟离子构成,二者数目之比为1:2,故A符合;
B.CO2是分子晶体,不属于离子化合物,故B不符合;
C.NaCl中阴阳离子个数比为1:1,故C不符合;
D.CsCl中阴阳离子个数比为1:1,故D不符合,
故选A.
点评:
本题考查晶胞的计算,题目难度不大,注意均摊法的应用,注意选项中各物质的构成微粒.


科目:高中化学 来源: 题型:
0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是 ( )
A c(K+)+c(H +)=c(S2—)+c(HS—)+c(OH—) B c(K+)+ c(S2—) = 0.3mol/L
+)=c(S2—)+c(HS—)+c(OH—) B c(K+)+ c(S2—) = 0.3mol/L
C c(K+)=c(S2—)+c(HS—)+c(H2S) D c(OH-)=c(H+)+c(HS—)+2c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl晶体的结构中,与每个钠离子距离最近且相等距离的Cl﹣所围成的空间构型为( )
|
| A. | 简单立方 | B. | 正四面体 | C. | 正八面体 | D. | 三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的比较顺序中,不正确的是( )
|
| A. | 热稳定性:HF>HCl>HBr>HI |
|
| B. | 微粒半径:K+>Na+>Mg2+>Al3+ |
|
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
|
| D. | 熔点:金刚石>Hg>KCl>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
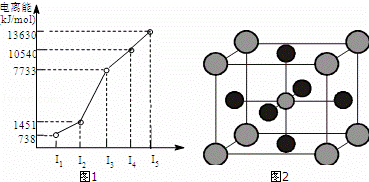
X、Y、Z三种元素,原子序数依次减小.X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn.回答下列问题:
(1)X原子的电子排布式为 .由X元素构成的单质属于 晶体.
(2)电负性:X Y(填“>”、“=”或“<”).
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的化工原料.有关Z2H4分子的说法正确的是 (填字母).
A.分子中含有氢键
B.能使酸性高锰酸钾溶液褪色.
C.含有5个σ键和1个π键
D.Z的原子与氢原子形成的化学键可以旋转
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构示意图如图2所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心).
该晶体的化学式为: ;
推测该晶体具有下列那些物理性质:
A:固态时能导电. B:熔化状态能导电.C:有较高的熔点. D:硬度很小.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,反应A2(g)+B2(g)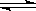 2AB(g)达到反应限度的标志是
2AB(g)达到反应限度的标志是
A.A2、B2和AB共存
B.A2、B2和AB的物质的量不再改变
C.c(A2):c(B2):c(AB)=1 :1 :2
D.A2和B2的物质的量之和与AB的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列八种晶体:
①水晶 ②干冰 ③氟化钠 ④固态氩 ⑤金属铝 ⑥碳化硅 ⑦氢氧化钠 ⑧白磷
试回答:
. 直接由原子构成的晶体是____________。
.含有共价键的晶体是________________。
含有阳离子的晶体是______________,含有阴离子的晶体是________________。
熔化需克服共价键的晶体是_________ ,熔化能导电的晶体是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com