
【题目】用铂电极惰性电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )
A 稀NaOH溶液 B HCl溶液 C NaCl溶液 D 酸性AgNO3溶液
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下表是食用碘盐包装上的部分说明,下列说法正确的是( )
配料 | 精盐、碘酸钾、抗结剂 |
碘含量 | 35±15 mg·kg-1 |
储存方法 | 密封、避光、防潮 |
食用方法 | 烹饪时,待食品熟后加入碘盐 |
A.高温会导致碘的损失 B.碘酸钾可氧化氯化钠
C.可用淀粉检验碘盐中的碘酸钾 D.该碘盐中碘酸钾含量为20~50 mg·kg-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实,找出不能用勒沙特列原理解释的是( )
A.溴水中存在如下平衡![]() ,当加入NaOH溶液后颜色变浅
,当加入NaOH溶液后颜色变浅
B.对![]()
![]()
![]() 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C.反应![]()
![]()
![]() 升高温度使平衡向逆方向移动
升高温度使平衡向逆方向移动
D.合成氨反应:![]()
![]()
![]() ,为使氨的产率提高,理论上应采取低温高压的措施
,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象中,能用范德华力解释的是
A. 氮气的化学性质稳定 B. 通常状况下,溴呈液态,碘呈固态
C. 水的沸点比硫化氢高 D. 锂的熔点比钠高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol ·L-1、0.1 mol ·L-1、0.2 mol ·L-1。当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol ·L-1、0.1 mol ·L-1、0.2 mol ·L-1。当反应达平衡时,可能存在的数据是
A. SO2为0.4 mol ·L-1,O2为0.2 mol ·L-1 B. SO2为0.25 mol ·L-1
C. SO2、SO3均为0.15 mol ·L-1 D. SO3为0.4 mol ·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤造成空气污染。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
写出该反应平衡常数表达式:K=__________。
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)________V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是__________。
A. 容器中密度不变
B. 容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2) :v(H2) =1:3
E.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
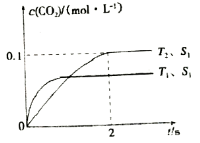
①在T2温度下,0~2 s内的平均反应速率v(N2)=__________;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1〉S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线。
(3)工业上用CO和H2合成 CH3OH:CO (g) +2H2 (g) ![]() CH3OH (g)
CH3OH (g)
①现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是____________
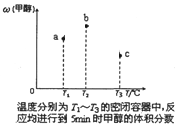
A.正反应的△H>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可使甲醇的含量由b点变成c点
D.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com