
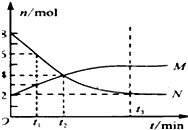
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:N?2M |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、平衡时,N的转化率是75% |
| D、t1分钟内,反应速率:v(M)=2v(N) |
| n(消耗) |
| n(总量) |
| 6mol |
| 8mol |


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 条件的变化 | 升温 | 通氨气 | 加水 | 加NaOH(s) | 加NH4Cl(s) | 通CO2 |
| 电离平衡移动的方向 | ||||||
| n(OH-) | ||||||
| c(OH-) | ||||||
| c(NH3?H2O) | ||||||
| 导电能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0 | 20 | 40 | 60 | 80 | |
| c(N2O4)mol?L-1 | 0.100 | a | 0.050 | c | d |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | b | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
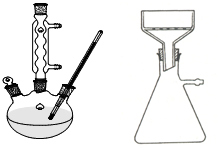 某实验室制取苯甲酸的过程如下:
某实验室制取苯甲酸的过程如下: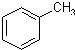 +2KMnO4
+2KMnO4| 反应Ⅰ |
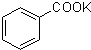 +MnO2+KOH+H2O
+MnO2+KOH+H2O| 温度/℃ | 4 | 18 | 75 |
| 溶解度/[g?(100gH2O)-1] | 0.18 | 0.27 | 2.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
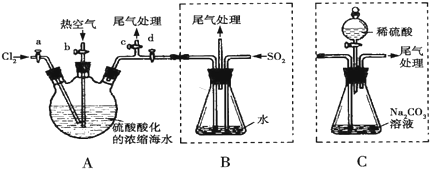
查看答案和解析>>
科目:高中化学 来源: 题型:
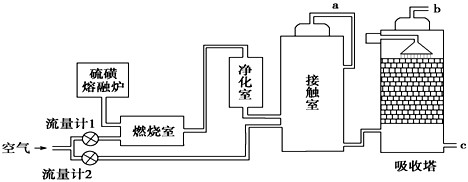
查看答案和解析>>
科目:高中化学 来源: 题型:
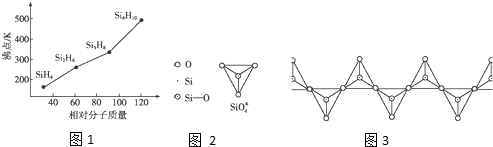
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com