
 有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.| ② | |||
| ⑦ | ⑧ |
| ||
| ||


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| A、0.56L甲烷中含有的共价键数为0.1NA |
| B、标准状况下,1mol SO3含有的氧原子数为3NA |
| C、含1mol AlCl3的溶液中,Al3+总数为NA |
| D、pH=1的稀硫酸中含有的H+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- |
| B、向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+H++Ba2++OH-═BaSO4↓+H2O |
| C、明矾水解的离子方程式:Al3++3H2O?Al(OH)3+3H+ |
| D、K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯分子的结构简式:CH2=CH2 | ||||
B、
| ||||
C、氟离子结构示意图: | ||||
D、丙烷分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、实验室可采用如图所示装置制取氨气 |
| B、用分液漏斗从石油里分离出汽油、煤油和石蜡 |
| C、用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质 |
| D、用碱式滴定管盛装KMnO4溶液滴定FeSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

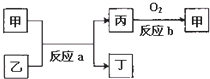
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4溶液和(NH4)2CO3溶液 c[(NH4)2SO4]<[(NH4)2CO3] |
| B、0.1mol/L的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| C、0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| D、10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合 c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Na+、K+、Al
| ||||
B、Fe2+、Na+、S
| ||||
C、Mg2+、N
| ||||
D、Ba2+、K+、Cl-、Mn
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com