
【题目】二氧化氯(![]() )具有强氧化性,
)具有强氧化性,![]() 协同氨法同时脱硫脱硝具有高脱除率。
协同氨法同时脱硫脱硝具有高脱除率。
(1)![]() 单独参与脱硝过程中发生以下反应:
单独参与脱硝过程中发生以下反应:
![]()
![]()
![]()
![]()
![]()
![]()
则反应![]() 的
的![]() ________
________![]()
(2)![]() 的浓度、吸收液
的浓度、吸收液![]() 对脱硫脱硝效率的影响分别如图所示,
对脱硫脱硝效率的影响分别如图所示,
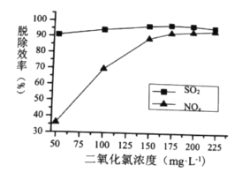
①最适宜的![]() 浓度为________
浓度为________![]() ;
;
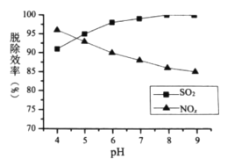
②![]() 时,随着
时,随着![]() 的增大,
的增大,![]() 的脱除率下降,其可能的原因是__________
的脱除率下降,其可能的原因是__________
③![]() 时,
时,![]() 会发生歧化反应:
会发生歧化反应:![]() ,当有
,当有![]() 完全反应时,转移电子数目为________
完全反应时,转移电子数目为________![]() ;歧化反应生成的
;歧化反应生成的![]() 也可以作为氧化剂进行脱硝反应,写出碱性条件下
也可以作为氧化剂进行脱硝反应,写出碱性条件下![]() 将
将![]() 氧化为
氧化为![]() 的离子方程式______________。
的离子方程式______________。
(3)工业上以不锈钢材料为阴极,表面覆盖金属氧化物的石墨为阳极,电解![]() 溶液制备
溶液制备![]() 。写出阳极产生
。写出阳极产生![]() 的电极反应式________;此方法的缺点是所得产品纯度不高,
的电极反应式________;此方法的缺点是所得产品纯度不高,![]() 气体中所含的杂质可能有_____________。
气体中所含的杂质可能有_____________。
【答案】![]() 175
175 ![]() 增加,
增加,![]() 氧化性减弱,脱硝效率下降 0.1
氧化性减弱,脱硝效率下降 0.1 ![]()
![]()
![]()
【解析】
(1)根据盖斯定律计算反应热;
(2)根据![]() 的浓度、吸收液
的浓度、吸收液![]() 对脱硫脱硝效率的影响图像分析解答;
对脱硫脱硝效率的影响图像分析解答;
③根据电子转移计算;根据得失电子守恒、电荷守恒、元素守恒配平该离子方程式;
(3)根据电解原理分析解答。
(1)已知热化学方程式:①![]()
![]() ;
;
②![]()
![]() ;
;
③![]()
![]() ;
;
根据盖斯定律可知,由①+![]() ②+
②+![]() ③可得目标方程式,则反应
③可得目标方程式,则反应![]() 的
的![]()
![]()
![]() ;
;
(2)①由图可知,![]() 的浓度为175
的浓度为175![]() 时,脱硫效率最高,而高于175
时,脱硫效率最高,而高于175![]() 时,脱硝效率增大不明显,故最适宜的
时,脱硝效率增大不明显,故最适宜的![]() 浓度为175
浓度为175![]() ;
;
②![]() 时,随着
时,随着![]() 的增大,
的增大,![]() 的脱除率下降,其可能的原因是
的脱除率下降,其可能的原因是![]() 增加,
增加,![]() 氧化性减弱,脱硝效率下降;
氧化性减弱,脱硝效率下降;
③![]() 时,
时,![]() 会发生歧化反应:
会发生歧化反应:![]() ,该反应中,+4价的Cl,既有化合价升高到+5价,又有化合价降低到+3价,故有2mol
,该反应中,+4价的Cl,既有化合价升高到+5价,又有化合价降低到+3价,故有2mol![]() 参加反应时,转移1mol电子,则当有
参加反应时,转移1mol电子,则当有![]() 完全反应时,转移电子数目为0.1
完全反应时,转移电子数目为0.1![]() ;
;![]() 在碱性条件下可以将
在碱性条件下可以将![]() 氧化为
氧化为![]() ,根据得失电子守恒、电荷守恒、元素守恒配平该离子方程式为
,根据得失电子守恒、电荷守恒、元素守恒配平该离子方程式为![]() ;
;
(3)电解池中阳极发生氧化反应,电解![]() 溶液制备
溶液制备![]() 时,Cl元素由-1价升高为+4价,则该过程应在阳极发生,则阳极产生
时,Cl元素由-1价升高为+4价,则该过程应在阳极发生,则阳极产生![]() 的电极反应式为
的电极反应式为![]() ;阳极也可能发生反应
;阳极也可能发生反应![]() ,故此方法的缺点是所得产品纯度不高,
,故此方法的缺点是所得产品纯度不高,![]() 气体中所含的杂质可能有
气体中所含的杂质可能有![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 |
HClO | 3×10-8 |
H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 |
H2S | K1=1.3×10-7 K2=7.1×10-15 |
请回答下列问题:
(1)同浓度的CH3COO-、![]() 、
、![]() 、
、![]() 、ClO-、S2-中结合H+的能力最弱的是_____________。
、ClO-、S2-中结合H+的能力最弱的是_____________。
(2)常温下0.1molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____________(填字母)。
A.c(H+) B.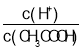 C.
C.![]() D.c(OH-)
D.c(OH-)
(3)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK_____________NaClO,两溶液中:c(Na+)-c(ClO)_____________c(K+)-c(CH3COO-)(填“>”“<”或“=”)。
(4)向0.1molL-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5∶9,此时溶液pH=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关合成氨工业的叙述,能够用勒·夏特列原理来解释的是
A.加入催化剂可以提高单位时间氨的产量
B.高压比常压条件更有利于合成氨的反应
C.500℃高温比室温更有利于合成氨的反应
D.N2和H2按物质的量之比1:2.8混合,更有利于氨的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是应用广泛的有机高分子化合物,其中合成M的一种路线如下(部分反应条件略去):
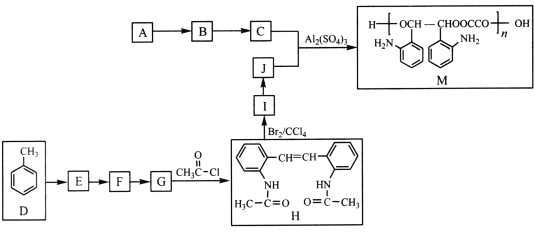
已知:①A的实验式为CH3O。
②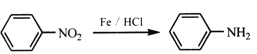 (-NH2容易被氧化)
(-NH2容易被氧化)
③![]()
④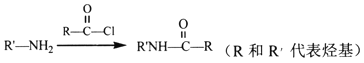
⑤![]()
回答下列问题:
(1)E的化学名称为_____________________________。
(2)H中官能团的名称为____________________________。
(3)D→E、I→J的转化过程中所用试剂和反应条件分别是_________、__________。
(4)C+J→M的化学方程式为_________________________________。
(5)同时满足下列条件的F的同分异构体有______种(不考虑立体异构)。
①含有的官能团与F相同;
②碳架结构与F完全相同;
③两个含氮官能团分别连在两个不同苯环上。
F的所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器为_______________(填序号)。
A.元素分析仪 B.红外光谱仪 C.质谱仪 D.核磁共振波谱仪
(6)参照上述合成路线和信息,以A和甲苯为有机原料(无机试剂任选),设计制备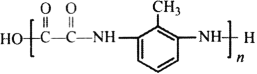 的合成路线。
的合成路线。
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.2mol/LNH4HCO3溶液(pH>7):c(![]() )>c(
)>c(![]() ),c(H2CO3)>c(NH3H2O)
),c(H2CO3)>c(NH3H2O)
B.0.2mol/L氨水:0.2mol/L>c(OH-)+ c(NH3H2O)
C.向0.1mol/LNH4HCO3溶液中通入CO2至溶液pH=7:c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
D.pH=2的盐酸与pH=12的氨水等体积混合:c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见温室气体,B为淡黄色氧化物,C为常见液体,D为黄绿色气体单质,相互反应的关系如右图所示,M的水溶液能杀菌消毒。下列有关叙述正确的是
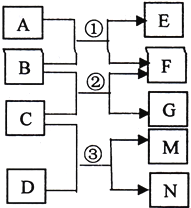
A. 4.4gA含有4.4NA个质子
B. 7.8gB与足量A发生反应①,共转移0.2NA电子
C. 反应③的离子方程式为:Cl2+H2O![]() 2H++Cl-+ ClO-
2H++Cl-+ ClO-
D. M的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图,下列关于分枝酸的叙述正确的是
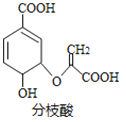
A.分子中含有5种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物P的结构片段如图所示。下列说法不正确的是(图中![]() 表示链延长)
表示链延长)

A. 聚合物P中有酯基,能水解
B. 聚合物P的合成反应为缩聚反应
C. 聚合物P的原料之一丙三醇可由油脂水解获得
D. 邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2A为二元弱酸。室温下,下列指定溶液中微粒物质的量浓度关系正确的是(忽略溶液混合引起的体积变化)( )
A.0.1mol/LH2A溶液:c(H2A)>c(HA-)>c(A2-)>c(H+)
B.0.1mol/LNaHA溶液(pH<7):c(Na+)>c(HA-);c(H2A)>c(A2-)
C.0.1mol/LNaHA溶液和0.1mol/LNaOH溶液等体积混合:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.0.1mol/LNaHA溶液(pH<7)和0.1mol/LH2A溶液等体积混合:c(Na+)>c(HA-)+2c(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com