
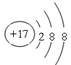
 (3) 13; 1s22s22p6;
(3) 13; 1s22s22p6;  。
。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| X | Y | |
| | Z | W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 族 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | | | | | | | |
| 2 | | | | ② | | ③ | | |
| 3 | | | ④ | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 )如下表所示:
)如下表所示:
A.a、b、c的化学式分别为 、 、 、 、 |
| B.第②组物质均有氧化性;第③组物质对应水溶液均是强酸 |
C.第④组中各化合物的稳定性顺序为: |
| D.上表中同族物质对应的氢化物的沸点,均随相对分子质量的增大而升高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com