
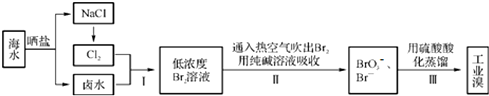
分析 由流程可知,海水晒盐得到NaCl、卤水(含溴离子),电解NaCl生成氯气,氯气与卤水发生氧化还原反应生成溴,利用纯碱吸收发生3Br2+3CO32-═5Br-+BrO3-+3CO2↑,酸性条件下溴酸根离子和溴离子发生氧化还原反应得到溴单质,然后蒸馏可得到工业溴.
(1)步骤Ⅰ中已获得游离态的溴的含量较低;
(2)Br元素的化合价由0升高为+5价,Br元素的化合价由0降低为-1价,结合电子、电荷守恒分析;
(3)溴与二氧化硫水溶液反应,生成硫酸和HBr;
(4)碱性溶液及具有还原性的物质均可吸收溴;
(5)与水互溶的液体,不能作萃取剂.
解答 解:由流程可知,海水晒盐得到NaCl、卤水(含溴离子),电解NaCl生成氯气,氯气与卤水发生氧化还原反应生成溴,利用纯碱吸收发生3Br2+3CO32-═5Br-+BrO3-+3CO2↑,酸性条件下溴酸根离子和溴离子发生氧化还原反应得到溴单质,然后蒸馏可得到工业溴.
(1)步骤Ⅰ中已获得游离态的溴的含量较低,步骤Ⅱ又将之转化为化合态的溴,其目的是富集溴,故答案为:富集溴;
(2)Br元素的化合价由0升高为+5价,Br元素的化合价由0降低为-1价,由电子、电荷守恒可知,离子反应为3Br2+3CO32-═5Br-+BrO3-+3CO2↑,
故答案为:3;3;5;1;3;
(3)溴与二氧化硫水溶液反应,生成硫酸和HBr,离子反应为Br2+SO2+2H2O═4H++SO42-+2Br-,故答案为:Br2+SO2+2H2O═4H++SO42-+2Br-;
(4)碱性溶液及具有还原性的物质均可吸收溴,则abc均可吸收溴,故答案为:abc;
(5)与水互溶的液体,不能作萃取剂,只有bd可作萃取剂,故答案为:bd.
点评 本题考查混合物分离提纯的综合应用及海水提溴,为高频考点,把握流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是
也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(R2-)+c(OH-)=c(Na+)+c(H+) | B. | c(R2-)>c(Na+)>c(H+)=c(OH-) | ||
| C. | 2c(R2-)+c(HR-)=c(Na+) | D. | 混合后溶液的体积为2aL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
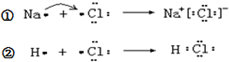 下列说法不正确的是( )
下列说法不正确的是( )| A. | ①和②变化过程中都会放出热量 | |
| B. | 氯原子吸引电子的能力强于钠原子和氢原子 | |
| C. | NaCl中含有离子键,HCl中含有极性共价键 | |
| D. | ①和②中的氯原子均得到1个电子达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH3 sp2 平面三角形 | B. | SO32- sp2 平面三角形 | ||
| C. | SO2 sp2 V形 | D. | NO3- sp3 三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应,碳酸氢钠产生的二氧化碳多 | |
| B. | 等物质的量的盐酸分别与足量的碳酸钠和碳酸氢钠反应,碳酸氢钠产生的二氧化碳多 | |
| C. | 相同温度在水中的溶解度:碳酸钠大于碳酸氢钠 | |
| D. | 用氢氧化钙溶液鉴别碳酸钠和碳酸氢钠两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0△S>0的反应均是自发反应 | |
| B. | 自发进行的反应一定能迅速进行 | |
| C. | 冰在室温下自动熔化成水,不是熵增的结果 | |
| D. | 非自发进行的反应一定不可能发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com