
【题目】下列化合物中,既含有离子键,又含有非极性共价键的是 ( )
A. CaO B. SiO2 C. NH4Cl D. Na2O2
 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】常温时,用0.1000mol/ LNaOH溶液滴定25.00mL0.1000mol/L某一元酸HX溶液,滴定过程中pH变化曲线如图所示。下列说法正确的是
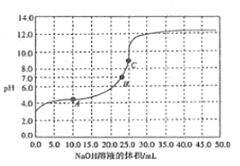
A. HX为强酸
B. 在A点,c(HX)>c(X-)>c(Na+)>c(H+)>c(OH-)
C. 在B点,两者恰好完全反应
D. 在C点.c(X-)+ c(HX)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1) 的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:D离子>C离子>A离子>B离子
B. D元素氧化物的水化物一定是强酸
C. B、C的简单离子都能破坏水的电离平衡
D. 氢化物还原性:C >D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜( As2O3)中毒,涉及的反应如下:
I:6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷)↑+3H2O
Ⅱ:2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布图______________。
(2)砷烷的空间结构为_______;砷烷中心原子杂化方式为________。
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3→AsH3→SbH3熔沸点依次升高的原因是_________;NH3分子例外的原因是_______。
(4)第一电离能数据I(As)>I(Se),可能的原因是_____________。
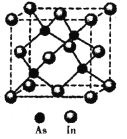
(5)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其晶胞结构如图所示,则其化学式为______;晶胞边长a= 666.67pm,则其密度为_____g/cm3(边长a可用![]() 近似计算,设NA=6.0×1023/mol)。
近似计算,设NA=6.0×1023/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的的是
A. 用溴水检验汽油中是否含有不饱和脂肪烃
B. 除去苯中混有的苯酚,加入浓溴水,过滤
C. 除去乙醇中混有的水,加入金属钠,蒸馏
D. 乙烷气体中混有乙烯, 通入酸性高锰酸钾溶液,洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 氢键是一种化学键
B. 冰中存在氢键、液态氟化氢中不存在氢键
C. H2O是一种非常稳定的化合物,这是由于氢键所致
D. 氨气极易溶于水,重要的原因之一是由于氨分子与水分子之间能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHS溶液中加入一定量的CuSO4溶液,发生的反应的离子方程式可能为( )
A.S2﹣+Cu2+→CuS↓
B.2HS﹣+Cu2+→CuS↓+2H++S2﹣
C.HS﹣+Cu2+→CuS↓+H+
D.2HS﹣+Cu2+→CuS↓+H2S↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kP时,甲烷、乙烷和丙烯组成的混合烃32ml,与过量氧气混合并完全燃烧,气体经过浓硫酸干燥,恢复到原来的温度和压强,气体总体积缩小72ml,原混合烃中甲烷、乙烷、丙烯的体积比可能为( )
A. 3:2:1 B. 2:1:2 C. 4:2:5 D. 1:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com