
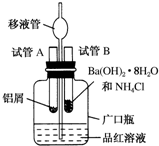
 某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:
某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:分析 (1)因为实验过程中涉及压强的变化,而品红液面的变化,所以整个装置气密性是否良好,所以探究实验前首先检查装置的气密性;
(2)铝与盐酸反应是放热反应,所以广口瓶中气体体积鼓胀,移液管中的液面上升;正反应是放热反应,所以断裂化学键所吸收的能量小于形成化学键所释放的能量;(3)步骤④向试管B中加入3g Ba(OH)2•8H2O和1.5g NH4Cl晶体中滴加适量水,反应是吸热反应,所以广口瓶中气体的压强减小,所以移液管中的红色液体快速下降,而反应是吸热反应,所以试管B的反应中反应物的总能量小于生成物的总能量.
解答 解:(1)因为实验过程中涉及压强的变化,而品红液面的变化,所以整个装置气密性是否良好,所以探究实验前首先检查装置的气密性,故答案为:有;没有检验装置的气密性;
(2)铝与盐酸反应是放热反应,所以广口瓶中气体体积鼓胀,移液管中的液面上升;正反应是放热反应,所以断裂化学键所吸收的能量小于形成化学键所释放的能量,故答案为:广口瓶中有红色液体逐渐上升,并进入移液管的球泡内;C;
(3)步骤④向试管B中加入3g Ba(OH)2•8H2O和1.5g NH4Cl晶体中滴加适量水,反应是吸热反应,所以广口瓶中气体的压强减小,所以移液管中的红色液体快速下降,而反应是吸热反应,所以试管B的反应中反应物的总能量小于生成物的总能量,故答案为:移液管中的红色液体快速下降;小于.
点评 本题考查了探究化学反应与能量变化的关系,题目难度中等,注意掌握化学反应与能量变化的关系,明确氢氧化钡晶体与氯化铵反应中的能量变化,试题培养了学生的分析、理解能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 9g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 22.4L乙烷中含有的共价键数为7NA个 | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 | |
| D. | 4.2g C3H6中含有的碳碳双键数一定为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 53% | B. | 46% | C. | 18% | D. | 36% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 | |
| D. | 酚和醇的羟基性质差别较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$ R | B. | ${\;}_{a-2}^{a+b-2}$ R | C. | ${\;}_{a+2}^{a+b+2}$ R | D. | ${\;}_{a-2}^{a+b}$ R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 | |
| C. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 | |
| D. | 常温下,V1L pH=11的NaOH溶液与V2L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4(aq)滴定H2C2O4(aq)的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O | |
| B. | KMnO4标准溶液应用式碱滴定管盛装 | |
| C. | 滴定终点时的现象为:最后1滴标准KMnO4(aq)使锥形瓶中溶液由无色变为浅紫色,且约半分钟内不褪色 | |
| D. | 经计算该样品中钙离子浓度为1.000×10-4g•mL-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com