
某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸 B.用托盘天平称量25.20g NaCl
C.用广范pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
A.氧化性Cr2O72->Fe3+>SO2
B.K2Cr2O7能将Na2SO3氧化成Na2SO4
C.每有1molK2Cr2O7参加反应,转移电子的数目为6NA
D.若6.72 L SO2(标准状况)参加反应,则最终消耗0.2molK2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)已知在448℃时,反应H2(g)+I2(g) 2HI(g)的平衡常数K1为49,则该温度下 反应
2HI(g)的平衡常数K1为49,则该温度下 反应 H2(g)+
H2(g)+ I2(g)
I2(g) HI(g)的平衡常数K2为__________。
HI(g)的平衡常数K2为__________。
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________________。
(2)该反应为__________反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是( )。
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D. c(CO2)=c(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中不正确的是
A.甲醇分子内C原子的杂化方式为sp3杂化
B.甲醇分子内的O—C—H键角大于甲醛分子内的O—C—H键角
C.甲醛分子内C原子上无孤对电子
D.甲醛分子两个C—H键夹角小于120°
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1) 在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(2) Y与Z可形成YZ42-,YZ42-的空间构型为 (用文字描述)。
(3) X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有配位键的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关滴定操作的顺序正确的是
①用标准溶液润洗滴定管②往滴定管内注入标准溶液③检查滴定管是否漏水④滴定⑤洗涤
A. ⑤①②③④ B. ③⑤①②④
C. ⑤②③①④ D. ②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
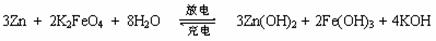
下列叙述不正确的是
A. 放电时负极反应为:Zn - 2e— + 2OH— == Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3 -3e— + 5OH— == FeO42— + 4H2O
C. 放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.NH4HSO3溶液与过量的NaOH溶液混合:NH4++OH- ==-NH3·H2O
B.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4- == 5SO42- + 2Mn2+ +3H2O
C.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+== CO2↑+H2O
D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I- = 2Fe2++I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com