
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O═2NaHCO3↓ | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| D. | 漂白粉溶液中加入醋酸:CH3COOH+ClO-═HClO+CH3COO- |
分析 A.次氯酸为弱酸,应保留化学式;
B.饱和Na2CO3溶液中通入足量CO2生成碳酸氢钠晶体;
C.碘酸钾与碘化钾在酸性环境下反应生成碘和水;
D.二者反应生成次氯酸和醋酸钙.
解答 解:A.氯气溶于水,离子方程式:Cl2+H2O═H++Cl-+HClO,故A错误;
B.饱和Na2CO3溶液中通入足量CO2,离子方程式:2Na++CO32-+CO2+H2O═2NaHCO3↓,故B正确;
C.酸性溶液中KIO3与KI反应生成I2,离子方程式:IO3-+5I-+6H+═3I2+3H2O,故C正确;
D.漂白粉溶液中加入醋酸,离子方程式:CH3COOH+ClO-═HClO+CH3COO-,故D正确;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 质子数 | B. | 质量数 | C. | 中子数 | D. | 电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | Fe2+、I-、Cl-三种离子一定存在 | |
| B. | 不能确定Na+和Cl-是否存在,CO${\;}_{3}^{2-}$一定不存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)≥0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向右移动,CH3COOH电离常数增大 | |
| B. | 加入少量CH3COONa固体,平衡向右移动 | |
| C. | 加入少量NaOH固体,平衡向右移动,c(H+)减小 | |
| D. | 加入少量pH=5的硫酸,溶液中c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃钢和钢化玻璃成分不同,但都属于复合材料 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | H2、SO2、Cl2都可用浓硫酸干燥 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
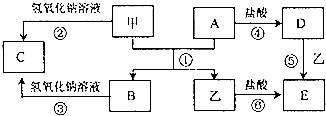
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ||
| ④ | ⑤ | ⑥ | ⑦ |
 、
、 ,这两种离子的半径大小顺序是S2->Cl-(填化学式).
,这两种离子的半径大小顺序是S2->Cl-(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某气体$\stackrel{通入品红溶液中}{→}$品红溶液褪色 结论:某气体一定是SO2 | |
| B. | 某气体$\stackrel{通入澄清石灰水}{→}$ 产生白色沉淀 结论:某气体一定是CO2 | |
| C. | 某溶液$\stackrel{打开瓶盖}{→}$冒白雾$\stackrel{将沾有浓氨水的玻璃棒靠近}{→}$ 白烟 结论:原溶液一定是浓盐酸 | |
| D. | 某溶液$\stackrel{滴加KSCN溶液液}{→}$ 血红色溶液 结论:原溶液中一定含有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com