
���� ��ɫ����������NaOH��Һ��ӦΪAl��OH��3��˵�����к���Al��H����Ԫ�أ�n��H2��=$\frac{6.72L}{22.4L/mol}$=0.3mol��
��m��H��=0.3mol��2��1g/mol=0.6g����6.00g�����m��Al��=6.00g-0.6g=5.4g��n��Al��=$\frac{5.4g}{27g/mol}$=0.2mol��
����n��Al����n��H��=0.2mol��0.6mol=1��3����Ļ�ѧʽΪAlH3�����ڱ�״���µ��ܶ�Ϊ1.25g•L-1����������ԭ������Ϊ1.25g•L-1��22.4L=28��ӦΪN2������ΪNH3����϶�Ӧ�������Լ���ĿҪ��ɽ����⣮
��� �⣺��ɫ����������NaOH��Һ��ӦΪAl��OH��3��˵�����к���Al��H����Ԫ�أ�n��H2��=$\frac{6.72L}{22.4L/mol}$=0.3mol��
��m��H��=0.3mol��2��1g/mol=0.6g����6.00g�����m��Al��=6.00g-0.6g=5.4g��n��Al��=$\frac{5.4g}{27g/mol}$=0.2mol��
����n��Al����n��H��=0.2mol��0.6mol=1��3����Ļ�ѧʽΪAlH3�����ڱ�״���µ��ܶ�Ϊ1.25g•L-1����������ԭ������Ϊ1.25g•L-1��22.4L=28��ӦΪN2������ΪNH3��
��1�������Ϸ�����֪��ΪAlH3���ʴ�Ϊ��AlH3��
��2��AlH3��ˮ����������ԭ��Ӧ����Ӧ�ķ���ʽΪAlH3+3H2O=Al��OH��3��+3H2����
�ʴ�Ϊ��AlH3+3H2O=Al��OH��3��+3H2����
��3��þ���ڵ�����ȼ�����ɵ���þ����ѧʽΪMg3N2���ʴ�Ϊ��Mg3N2��
��4��NH3�ڼ�����������CuO��Ӧ������Cu������N2����Ӧ�ķ���ʽΪ��3CuO+2NH3$\frac{\underline{\;\;��\;\;}}{\;}$N2+3Cu+3H2O��Ҫ�жϲ������Ƿ���Cu2O���ɼ���ϡ���������Һ�Ƿ������������ȡ�����H2SO4�������Һ������˵�������к���
Cu2O����֮����Cu2O��
�ʴ�Ϊ��3CuO+2NH3$\frac{\underline{\;\;��\;\;}}{\;}$N2+3Cu+3H2O��ȡ�����H2SO4�������Һ������˵�������к���Cu2O����֮����Cu2O��
��5��AlH3�е�HΪ-1�ۣ�NH3�е�HΪ+1�ۣ��ӻ��ϼ۵ĽǶȿ�֪���߿��ܷ���������ԭ��Ӧ����������
�ʴ�Ϊ�����ܣ�AlH3�е�HΪ-1�ۣ�NH3�е�HΪ+1�ۣ��п��ܷ���������ԭ��Ӧ����������
���� ���⿼��������ƶϣ���Ŀ�Ѷ��еȣ�ע������ȹط�Ӧ�������Լ������жϼ����������ʣ�ע����ط�Ӧ�Ļ�ѧ����ʽ����д��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͭ | B�� | ����� | C�� | �������� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
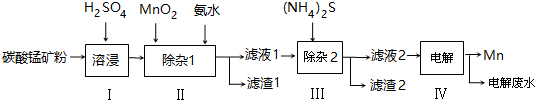
| ���� | Mn��OH��2 | Co��OH��2 | Ni��OH��2 | MnS | CoS | NiS |
| Ksp | 2.1��10-13 | 3.0��10-16 | 5.0��10-16 | 1.0��10-11 | 5.0��10-22 | 1.0��10-22 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
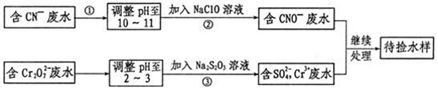
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molFe���ڹ������ᣬ����ת����Ϊ2NA | |
| B�� | 1molN2��4molH2��Ӧ���ɵ�NH3������Ϊ2NA | |
| C�� | ��״���£�2.24LCCl4���еĹ��ۼ���Ϊ0.4NA | |
| D�� | 14g��ϩ�ͱ�ϩ��������е���ԭ����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol•L-1NaCl��Һ����NA��Na+ | |
| B�� | 1mol Cl2������������Ӧ��ת�Ƶĵ�����Ϊ3NA | |
| C�� | 1 mol Na ������O2 ��Ӧ������Na2O��Na2O2�Ļ�����ʧȥNA������ | |
| D�� | �����ᷴӦ���ų���״���µ�22.4L���壬ת�Ƶĵ�������Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
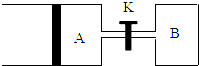 ��Ҫ����գ�
��Ҫ����գ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
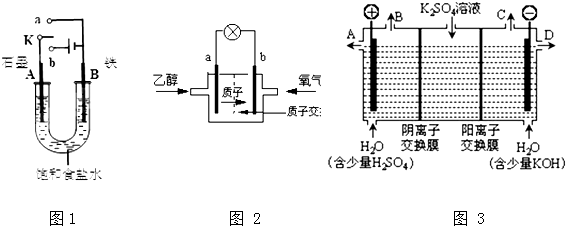
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com