
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
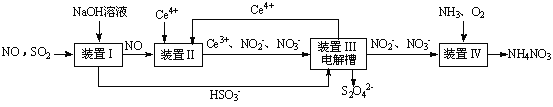
(1)装置Ⅰ中生成HSO3-的离子方程为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如右图所示。
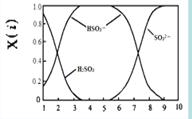
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。

①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(6)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
【知识点】无机流程、溶液中的离子浓度大小、电化学、计算
【答案解析】 (1)SO2 + OH-=== HSO3-(2分);
(2)①a、c (3分)
②HSO3-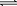 SO32-+H+,加入CaCl2溶液, Ca2++SO32-=== CaSO3↓使平衡右移,c(H+)增大。(3)NO+2H2O+3Ce4+===3Ce3++NO3-+4H+(3分)
SO32-+H+,加入CaCl2溶液, Ca2++SO32-=== CaSO3↓使平衡右移,c(H+)增大。(3)NO+2H2O+3Ce4+===3Ce3++NO3-+4H+(3分)
(4)①Ce3+- e-=== Ce4+ (2分) ② a (2分)
(5)243a(242a、244a、5600a /23都给分)(3分)
解析:(1)进入装置Ⅰ中的物质有:NaOH、NO、SO2,则生成HSO3-的离子方程为:
SO2 + OH-=== HSO3-
(2)①如图pH=8时,溶液中c(HSO3-) < c(SO32-)a正确。pH=7时,溶液中c(Na+)+c(H+) =c(HSO3-)+2c(SO32-)+c(OH-),c(H+)= c(OH-),所以b不正确。如图pH控制在4~5左右,溶液中没有HSO3-,所以c错。②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2原因为HSO3- SO32-+H+,加入CaCl2溶液, Ca2++SO32-=== CaSO3↓使平衡右移,c(H+)增大。
SO32-+H+,加入CaCl2溶液, Ca2++SO32-=== CaSO3↓使平衡右移,c(H+)增大。
(3)装置Ⅱ中,如流程图反应物为NO、Ce4+生成物有Ce3+、NO3-。根据电荷守恒和题意给出酸性溶液,反应物还有H2O,生成物还有H+。根据氧化还原原理和得失电子守恒配平得NO+2H2O+3Ce4+===3Ce3++NO3-+4H+。
(4)①根据流程图其电极方程式只能是Ce3+- e-=Ce4+。②由Ce3+- e-= Ce4+得阳极生成Ce4+,所以从电解槽的a口流出。
(5)根据得失电子守恒NO2-和O2的物质的量之比为2:1。得氧气的体积为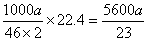 =243a 。
=243a 。
【思路点拨】本题考查了离子方式、电极方程式的书写,溶液中浓度大小的比较,氧化还原反应,利用电荷守恒计算。题目难度较大。注意从已知提取信息,培养看图分析能力。


科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,
其实验过程如下:
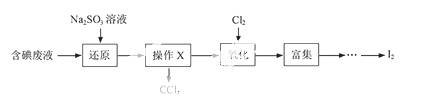
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
 (2)操作X的名称为 。
(2)操作X的名称为 。
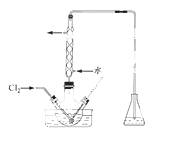
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2, 在400C左右反应(实验装置如右图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO32—+2IO3—+2H+ I2+5SO42—+H2O
I2+5SO42—+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3—中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3—的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在; 。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族
| IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)④、⑤、⑥的离子半径由大到小的顺序为 。
 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
 (3)①、④、⑤中的某些元素可形成既含离子键又含非极性共价键的化合物,写出一种化合物的电子式: 。
(3)①、④、⑤中的某些元素可形成既含离子键又含非极性共价键的化合物,写出一种化合物的电子式: 。
 (4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被催化分解,来加快产生常见的某气体;可使用的催化剂为(填序号) _。
(4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被催化分解,来加快产生常见的某气体;可使用的催化剂为(填序号) _。
 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
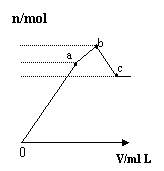
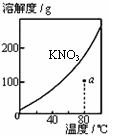
| |



图1 图2 图3 图4
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化、
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素。A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍。请回答下列问题:
(1)CD3 的电子式为 ;
(2)用离子方程式表示G 的非金属性比F强 ;
(3)EF在空气中充分灼烧生成一种稳定性的盐,则此反应方程式为 ;
(4)C的氢化物与G的单质以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,则X的化学是为 ,X与水反应的产物名称是
;
(5)已知充分燃烧一定量的B2A2放出Q kJ的能量,燃烧生成的产物恰好与100ml 5 mol·L-1的NaOH溶液完全反应生成正盐,则燃烧1mol B2A2放出的热量为 KJ;


(6)常温下,E(OH)2在水中的沉淀溶解平衡曲线如图所示(单位mol·L-1)。要使c(E2+) 为0.001 mol·L-1的溶液形成沉淀,则溶液的PH值至少升高到 。
查看答案和解析>>
科目:高中化学 来源: 题型:
异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效。它们在一定条件下可发生转化,如图所示。有关说法正确的是( )

A.异秦皮啶与秦皮素互为同系物
B.异秦皮啶分子式为C11H12O5
C.秦皮素一定条件下能发生加成反应、消去反应和取代反应
D.1mol秦皮素最多可与2molBr2(浓溴水中的)、4molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
化学工作者一直关注食品安全,发现有人将工业染料“苏丹红1号”非法用作食用色素。苏丹红是一系列人工合成染料,其中“苏丹红4号”的结构式如下:
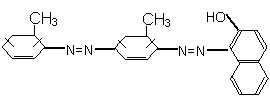 |
下列关于“苏丹红4号”说法正确的是( )
A.不能发生加成反应 B.可以使酸性高锰酸钾溶液褪色
C.属于芳香烃 D.属于甲苯同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
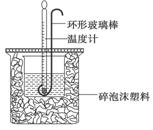 ①烧杯间填满碎泡沫塑料的作用是 。
①烧杯间填满碎泡沫塑料的作用是 。
②若大烧杯上改为盖薄铁板,求得的反应热数值:
(填“偏大”、“偏小”或“无影响”)
③若通过测定计算产生的热量为1.42kJ,请写该反应的
热化学方程式: 。
(2)①已知:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为: 。
②由气态基态原子形成1 mol化学键释放的最低能量叫键能。已知表中所列键能数据, 则
N2(g)+3H2(g)  2NH3(g) ΔH= kJ·mol-1。
2NH3(g) ΔH= kJ·mol-1。
| 化学键 | H—H | N—H | N≡N |
| 键能kJ·mol-1 | 436 | 391 | 945 |
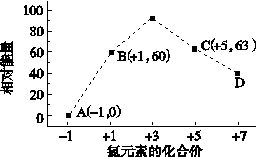
③一定条件下,在水溶液均为1 mol以下离子 Cl-、ClO-、ClO2-、ClO3-、ClO4-的能量(kJ)相对大小如下图所示,则3ClO-(aq)===ClO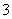 (aq)+2Cl-(aq)的ΔH= kJ·mol-1。
(aq)+2Cl-(aq)的ΔH= kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com