
【题目】一定符合以下转化过程的X是( )
X![]() 溶液W
溶液W![]() Z
Z![]() X
X
A.FeOB.SiO2C.Al2O3D.NH3
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】配位化合物在生产生活中有重要应用,请根据要求回答下列问题:
(1)光谱证实单质铝与强碱性溶液反应有![]() 生成,则
生成,则![]() 中存在__________(填序号)
中存在__________(填序号)
a.共价键 b.非极性键 c.配位键 d.![]() 键 e.π键
键 e.π键
(2)![]() 可形成两种钴的配合物,已知
可形成两种钴的配合物,已知![]() 的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加
的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加![]() 溶液时,产生白色沉淀,在第二种配合物的溶液中加
溶液时,产生白色沉淀,在第二种配合物的溶液中加![]() 溶液时,则无明显现象。则第一种配合物的结构可表示为____________________,第二种配合物的结构可表示为____________________。若在第二种配合物的溶液中滴加
溶液时,则无明显现象。则第一种配合物的结构可表示为____________________,第二种配合物的结构可表示为____________________。若在第二种配合物的溶液中滴加![]() 溶液,则产生的现象是____________________。(提示:
溶液,则产生的现象是____________________。(提示:![]() 这种配合物的结构可表示为
这种配合物的结构可表示为![]() 。)
。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,含有碳碳双键的某些有机化合物可被某些氧化剂氧化而生成含有醛基的化合物。例如,环丁烯(![]() )在一定条件下可被氧化成丁二醛。现有某有机化合物A(C6H8),在一定条件下与足量氢气反应可生成饱和有机化合物B(C6H12)。若用某氧化剂来氧化有机化合物A时,生成丙二醛(OHC-CH2-CHO)。回答下列问题:
)在一定条件下可被氧化成丁二醛。现有某有机化合物A(C6H8),在一定条件下与足量氢气反应可生成饱和有机化合物B(C6H12)。若用某氧化剂来氧化有机化合物A时,生成丙二醛(OHC-CH2-CHO)。回答下列问题:
(1)B的结构简式为______________,A的结构简式为_________________。
(2)写出满足下列条件的A的环状同分异构体的结构简式:________________、___________、_____________。
①所含碳环上的官能团与A相同且数目相等;
②所含碳环上的碳原子数比A少1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,2NH3(g)+NaClO(aq)=NaCl(aq)+N2H4(aq)+H2O(l)能自发进行,可用于生产N2H4。下列有关说法正确的是( )
A.该反应的ΔH>0,ΔS<0
B.每生成1molN2H4转移2mol电子
C.室温下,向0.1mol·L-1NaClO溶液中加水,溶液pH减少
D.N2H4、O2和KOH溶液组成的燃料电池,负极反应为N2H4-4e-=N2+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲是当代高科技材料不可缺少的重要组成元素。以铋碲矿(主要含Te、Bi、Si、S等元素)为原料生产精碲的工艺流程如下:
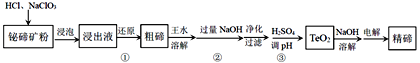
已知:TeO2是两性氧化物,微溶于水.回答下列问题:
(1)浸出液中碲以TeO2+存在,步骤①加入Na2SO3进行还原,反应的离子方程式为________。Na2SO3的实际用量比理论用量偏多,其主要原因是________。
(2)王水是由约3体积浓盐酸和约1体积浓硝酸配制而成。在实验室中配制王水所用的玻璃仪器除玻璃棒外还有________。王水溶解粗碲时,加入的碲粉与生成的NO的物质的量之比为________。
(3)粗碲中仍含有硅元素,净化时加入CaCl2溶液可以除去硅元素,硅元素将以________(填化学式)形式被除去。
(4)步骤③,将Na2TeO3转化为TeO2,反应的离子方程式是________。
(5)电解时,精碲在______极析出,电解产物中可循环使用的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地沟油泛指在生活中存在的各类劣质油,如回收的食用油、反复使用的炸油等。地沟油最大来源为城市大型饭店下水道的隔油池。长期食用可能会引发癌症,对人体的危害极大。根据以上信息和相关知识回答下列问题:
(1)下列说法正确的是__(填序号)。
A.掺假的“芝麻香油”(含有油酸甘油酯)能使溴水和酸性KMnO4溶液褪色,褪色原理相同
B.淀粉和油脂都是高分子化合物
C.地沟油可用来制肥皂
D.纤维素的最终水解产物与油脂水解产生的甘油含有某种相同的官能团
(2)地沟油中常常含有油酸甘油酯,在微生物作用下油酸甘油酯水解生成的不饱和脂肪酸中的碳碳双键在日光作用下被空气中的氧气氧化生成有臭味的醛或酮,这种过程称为“酸败”。
①试写出油酸甘油酯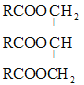 (—R为(CH3(CH2)7CH=CH(CH2)6CH2—)“酸败”过程中水解的化学方程式:__。
(—R为(CH3(CH2)7CH=CH(CH2)6CH2—)“酸败”过程中水解的化学方程式:__。
②工业上为了延缓不饱和油脂的“酸败”,通常采取的一种措施是在Ni催化作用下使油酸甘油酯与H2发生加成反应,1mol油酸甘油酯最多消耗__molH2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸、盐酸是生活中常见的物质。
(1)25℃时,浓度均为0.1mol·L-1的盐酸和醋酸溶液,下列说法正确的是___。
a.两溶液的pH相同
b.两溶液的导电能力相同
c.两溶液中由水电离出的c(OH-)相同
d.中和等物质的量的NaOH,消耗两溶液的体积相同
(2)25℃时,pH均等于4的醋酸溶液和盐酸溶液,醋酸溶液中水电离出的H+浓度与盐酸溶液中水电离出的H+浓度之比是___。
(3)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列叙述不正确的是___。
CH3COO-+H+,下列叙述不正确的是___。
a.CH3COOH溶液中离子浓度关系满足:c(H+)=c(OH-)+c(CH3COO)
b.0.1mol·L-1的CH3COOH溶液加水稀释,溶液中c(OHˉ)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后溶液的pH>7
e.室温下pH=3的醋酸溶液加水稀释,溶液中![]() 不变
不变
(4)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
a.加水稀释10倍后,醋酸溶液中的c(H+)__(填“>”“=”或“<”)盐酸溶液中的c(H+)。
b.加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸__(填“>”“=”或“<”)盐酸。
c.使温度都升高20℃,溶液中c(H+):醋酸__(填“>”“=”或“<”)盐酸。
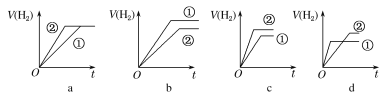
d.分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是__(填字母)。(①表示盐酸,②表示醋酸)
(5)将0.1mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是__(填字母)。
a.电离程度增大
b.溶液中离子总数增多
c.溶液导电性增强
d.溶液中醋酸分子增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚被称为“21世纪的清洁燃料”。利用甲醇脱水可制得二甲醚。反应方程式如下:2CH3OH(g)≒CH3OCH3(g)+H2O(g) ΔH1
(1) 二甲醚亦可通过合成气反应制得,相关热化学方程式如下:2H2(g)+CO(g)≒CH3OH(g) ΔH2
CO(g)+H2O(g)≒CO2(g)+H2(g) ΔH3 3H2(g)+3CO(g)≒CH3OCH3(g) +CO2(g) ΔH4
则ΔH1=__________________(用含有ΔH2、ΔH3、ΔH4的关系式表示).
(2)经查阅资料,上述甲醇脱水反应平衡常数Kp的计算式为lnKp= - 2.205+(2708.6137/T) (Kp为以分压表示的平衡常数,T为热力学温度),且催化剂吸附H2O(g)的量会受压强影响,从而进步影响催化效率。
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为CH3OCH3(g)的倾向__________ (填“增大”、“不变”或“减小”),ΔH4________2ΔH2+ΔH3 (填“>”、<”或“=”)。
物质 | CH3OH | CH3OCH3 | H2O |
分压/MPa | 0.50 | 0.50 | 0.50 |
②某温度下(此时Kp=100),在密闭容器中加入一定量CH3OH,某时刻测得各组分的压如下:
此时正、逆反应速率的大小:V正____V逆(填“>”、“<”或“=”)。
③200℃时,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为__________(填序号).
A.< 1/3 B.1/3 C.1/3~1/2 D.1/2 E.> 1/2
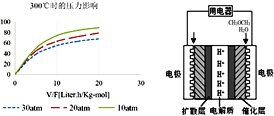
④300℃时,使CH3OH(g)以一定流速通过催化剂,V/F(按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请简述在上述条件下,压强对甲醇转化率影响的规律,并解释变化原因__________。
(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①负极的电极反应式为__________。
②现利用该电池电解CuC12溶液,当消耗2.3g二甲醚时,电解所得铜的质量为_________g(设电池的能量利用率为50%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W是一种药物的中间体,一种合成路线如图:

已知:①![]()
②![]()
请回答下列问题:
(1)A的系统命名为___。
(2)反应②的反应类型是__。
(3)反应⑥所需试剂为___。
(4)写出反应③的化学方程式为___。
(5)F中官能团的名称是___。
(6)化合物M是D的同分异构体,则符合下列条件的M共有__种(不含立体异构)。
①1molM与足量的NaHCO3溶液反应,生成二氧化碳气体22.4L(标准状态下);
②0.5molM与足量银氨溶液反应,生成108gAg固体其中核磁共振氢谱为4组峰且峰面积比为6∶2∶1∶1的结构简式为__(写出其中一种)。
(7)参照上述合成路线,以C2H5OH和![]() 为起始原料,选用必要的无机试剂合成
为起始原料,选用必要的无机试剂合成![]() ,写出合成路线__。
,写出合成路线__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com