
| A. | 水分子的比例模型: | B. | F-的结构示意图: | ||
| C. | H2O2的电子式: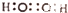 | D. | 葡萄糖的结构简式:C6H12O6 |
分析 A.水分子是V型分子,且题中为球棍模型;
B.F原子得到1个电子形成F-,质子数不变为9,核外电子数为10,有2个电子层,最外层电子数为8;
C.双氧水分子中不存在氧氧双键,氧原子最外层达到8电子稳定结构;
D.葡萄糖为多羟基醛,结构简式中需要标出官能团结构.
解答 解:A.水分子是V型,比例模型能够体现出原子的相对体积大小,其正确的比例模型为: ,故A错误;
,故A错误;
B.氟离子的核电荷数为9、核外电子总数为10,F-的结构示意图为: ,故B正确;
,故B正确;
C.双氧水为共价化合物,氧原子最外层达到8电子稳定结构,双氧水正确的电子式为: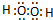 ,故C错误;
,故C错误;
D.葡萄糖中含有5个羟基、1个醛基,葡萄糖的结构简式为:CH2OHCHOHCHOHCHOHCHOHCHO,故D错误;
故选B.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握电子式、离子结构示意图、球棍模型与比例模型、结构简式等化学用语的概念及书写原则,C为易错点,注意明确双氧水的分子组成及成键情况.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入CH3COOH溶液后溶液显碱性:c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1的HF溶液与KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
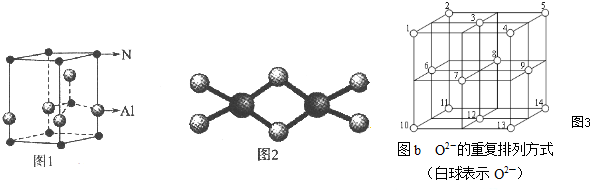
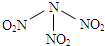
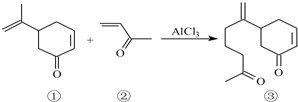
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
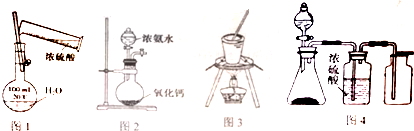
| A. | 用图1所示配制一定浓度的稀硫酸 | B. | 用图2装置实验室制取氨气 | ||
| C. | 用图3装置蒸发饱和食盐水 | D. | 用图4装置制取、收集乙炔气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层P轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)如图为1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=134KJ/mol,E2=368KJ/mol( E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1、△H的变化分别是减小、不变(填“增大”、“减小”或“不变”).写出该反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(1)如图为1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=134KJ/mol,E2=368KJ/mol( E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1、△H的变化分别是减小、不变(填“增大”、“减小”或“不变”).写出该反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在涂料中尽量用液态有机物代替水作溶剂,以减少环境污染 | |
| B. | 我国自行研制的“神七”航天服是由新型“连续纤维增韧”材料做成的,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | |
| C. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| D. | 食物溶于水后的溶液 pH<7,则该食物为成酸性食物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com