
| A. | 放电时,电池的负极反应为LiC6-e-═Li++C6 | |
| B. | 充电时,电池的正极反应为CoO2+Li++e-═LiCoO2 | |
| C. | 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 | |
| D. | 锂离子电池的比能量(单位质量释放的能量)低 |
分析 放电时,电池的正极发生得电子的还原反应,CoO2+Li++e-=LiCoO2,负极发生失电子的氧化反应,反应为LiC6-e-═Li++C6,充电时,电解池的阴极反应和放电时的负极反应互为逆过程,阳极反应和放电时的正极反应互为逆过程,由电解池的总反应来确定充放电时的电极反应,由于单质锂较活泼,易与羧酸以及醇反应而变质,电解质不能含有羧酸和醇.
解答 解:A、放电时,电池的负极发生失电子的氧化反应,电极反应为LiC6-e-═Li++C6,故A正确;
B、充电时是电解池原理,电池的正极和电源的正极相连,阳极上发生失电子的氧化反应,CoO2+Li++e-═LiCoO2是放电时的正极反应式,故B错误;
C、由于单质锂较活泼,易与醇以及羧酸类物质反应而变质,电解质不能含有醇和羧酸,故C错误.
D、锂离子电池的比能量高,故D错误.
故选A.
点评 本题考查锂电池的组成好工作原理,题目难度不大,本题注意锂电池的组成和工作原理,注意从总电池反应根据化合价的变化判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
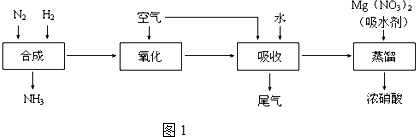
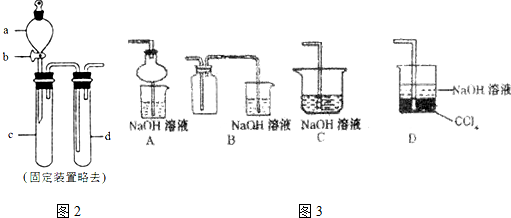
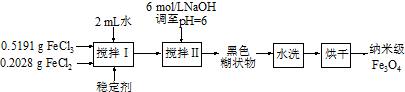
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池放电时Na+从b极区移向a极区 | |
| B. | 电极b采用MnO2,MnO2既作电极材料又有催化作用 | |
| C. | 每消耗1 mol H2O2,转移的电子为1 mol | |
| D. | 该电池的正极反应为BH4-+8OH--8e-═BO2-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
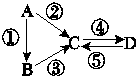 根据物质性质完成下列题型.
根据物质性质完成下列题型.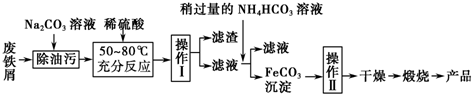
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
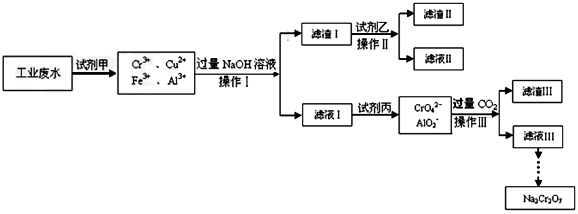
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
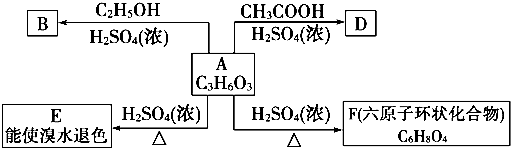
 ;反应类型:消去反应;
;反应类型:消去反应; ;反应类型:酯化反应或取代反应.
;反应类型:酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA | |
| B. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 1 molFe与足量的Cl2反应转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com