
����Ŀ���Ҷ��ᣨHOOC��COOH���ɼ�дΪH2C2O4���׳Ʋ��ᣬ��100�濪ʼ������157��ʱ��ʼ�ֽ⡣������KMnO4��Һ�ζ������ʵ�Na2C2O4��Ʒ����֪���ʲ���KMnO4��H2SO4��Һ��Ӧ����
ʵ�鲽�裺
ȷ��ȡ1g��ƷNa2C2O4���壬���100mL��Һ��ȡ��20.00mL����ƿ�С�����ƿ�м�������ϡH2SO4��Һ����0.016mol/L���������Һ�ζ����ζ����յ�ʱ���ĸ��������Һ25.00mL������֪��5H2C2O4+2KMnO4+3H2SO4=10CO2��+2MnSO4+K2SO4+8H2O��
(1)���������ҺӦװ��______________________________�ζ����С���������ʽ��������ʽ����
(2)�ζ����յ�ʱ��ʵ�������ǣ�___________________________________
(3)���в�������ʹ�������ƫ�ߵ���__________________________________��
A��ʢװ��Na2C2O4�ĵζ���û��ϴ
B��ʢװ���������Һ�ĵζ��ܵζ�ǰ���촦�����ݣ��ζ���������ʧ
C������ʱ�ζ�ǰ���ӣ��ζ�����
D����ƿ�в�������ˮ
(4)������Ʒ��Na2C2O4�Ĵ���___________________________________
���𰸡���ʽ ��Һ����ɫ��Ϊ��ɫ(�Ϻ�ɫ)���Ұ�����ڲ���ɫ B 67%
��������
�ȼ����20mL��Ʒ��Һ���ĸ�����ص����ʵ������ټ����100mL��Ʒ��Һ���ĸ�����ص����ʵ�����Ȼ����ݷ�Ӧ��������IJ����Ƶ����ʵ���������m=nM�����1g��������Ʒ�к��в����Ƶ����������������Ʒ�Ĵ��ȡ�
�����Ը��������Һ���������Ҿ���ǿ���������ܹ���ʴ��ʽ�ζ��ܵ���������Ӧ������ʽ�ζ�����ȡ��
��ˣ�������ȷ��������ʽ��
�ڵζ�����ǰ��ҺΪ��ɫ���ζ���������Һ����ɫ�����Եζ��յ������Ϊ����Һ����ɫ��Ϊ��ɫ(�Ϻ�ɫ)���Ұ�����ڲ���ɫ,
��ˣ�������ȷ��������Һ����ɫ��Ϊ��ɫ(�Ϻ�ɫ)���Ұ�����ڲ���ɫ��
��A.ʢװ��![]() �ĵζ���û��ϴ�����´���ҺŨ�ȼ�С�������ĸ��������Һ���ƫС���ⶨ���ƫС��
�ĵζ���û��ϴ�����´���ҺŨ�ȼ�С�������ĸ��������Һ���ƫС���ⶨ���ƫС��
B.ʢװ���������Һ�ĵζ��ܵζ�ǰ���촦���������ζ���������ʧ���������ĵı�Һ���ƫ�����ⶨ���ƫ����
C.����ʱ�ζ�ǰ�������ζ������������ĸ��������Һ���ƫС���ⶨ���ƫ����
D.��ƿ�в�������ˮ���Բⶨ�����Ӱ����
��ˣ�������ȷ������B��
��![]() ���������Һ�к��и�����ص����ʵ���Ϊ:
���������Һ�к��и�����ص����ʵ���Ϊ:![]() ��100mL����Ʒ��Һ��ȫ��Ӧ���ĸ�����ص����ʵ���Ϊ:
��100mL����Ʒ��Һ��ȫ��Ӧ���ĸ�����ص����ʵ���Ϊ:![]() �����ݷ�Ӧ5H2C2O4+2KMnO4+3H2SO4=10CO2��+2MnSO4+K2SO4+8H2O ����֪����
�����ݷ�Ӧ5H2C2O4+2KMnO4+3H2SO4=10CO2��+2MnSO4+K2SO4+8H2O ����֪����![]() ������Ʒ�к��в����Ƶ����ʵ���Ϊ:
������Ʒ�к��в����Ƶ����ʵ���Ϊ:![]() ,����Ϊ:
,����Ϊ:![]() ������
������![]() �Ĵ���Ϊ:
�Ĵ���Ϊ:![]() ��
��


 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ͬpH���������ƺʹ�������Һ��ˮϡ�ͣ�ƽ��ʱpH����Һ����仯��������ͼ��ʾ����������������ȷ����

A.b��c������Һ�ĵ�����������ͬ
B.a��b��c������Һ��ˮ�ĵ���̶�a>c>b
C.c����Һ��C(H+) + C(CH3COOH)= C(OH��)
D.����ͬŨ�ȵ�����ֱ���������b��c����Һ��Ӧ�������������Vb=Vc
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ʹ��Au �����CO2 �ϳɼ���ķ�Ӧ������ͼ��ʾ������˵������ȷ����
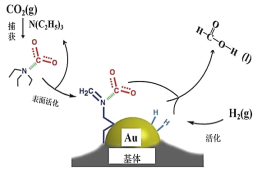
A.������̼�ĵ���ʽΪ![]()
B.�ڲ�����̣�������̼�����еĹ��ۼ���ȫ����
C.N(C2H5)3 �ܹ�Э��������̼�����������
D.CO2 ������ϳɼ�����ܷ�ӦʽΪH2(g)��CO2(g)��HCOOH(l)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����������ʯβ��(��Ҫ�ɷ�ΪMgO������FeO��Fe2O3��Al2O3��)�Ʊ������Ȼ�þ����(MgCl2��6H2O)��ʵ���������£�

��֪���ֽ����������γ������������ʱ��pH���±���
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
��ʼ����ʱ | 7.6 | 2.7 | 4.2 | 9.6 |
������ȫʱ | 9.6 | 3.7 | 5.4 | 11.1 |
�ش��������⣺
(1)����ȡ�������У��ܼӿ��ȡ���ʵķ�����____________��__________(��д����)��
(2)����X�ĵ���ʽΪ________������1�������������Ƶ�һ�ָ�Ч�����߷��ӻ���������ˮ�����仯ѧʽΪ[Fe2(OH)n(SO4)(3��0.5n)]m�������������Ԫ�صĻ��ϼ�Ϊ________��
(3)����H2O2��Ŀ����______________________���������������е���H2O2������NaClO������Ҳ�ܴﵽͬ��Ŀ�ģ�������Ӧ�����ӷ���ʽΪ��________________________________��
(4)��һϵ�в�������Ҫ���������������ᣬȻ��____________________�����ˡ�ϴ�ӣ����õ��Ȼ�þ���塣
(5)ȷ��ȡ2.000 g�Ȼ�þ�����Ʒ��250 mL��ƿ�У���ˮ50 mLʹ����ȫ�ܽ⣬����100 mL���Ի���Һ����������Tָʾ������Һ�Ծƺ�ɫ���ڲ������£���0.5000 mol/L��EDTA����Һ���еζ����䷴Ӧԭ��ΪMg2+��Y4- ==MgY2-���ζ��յ�ʱ����EDTA����Һ�����19.00 mL��
�����Ʒ��MgCl2��6H2O����������Ϊ________(���������λ��Ч����)��
�����еζ������ᵼ�²������ƫ�ߵ���________(����ĸ)��
a���ζ��յ�ʱ���Ӷ��� b����ƿϴ�Ӻ�û�и���
c���ζ�ʱ��ƿ����Һ�彦�� d���ζ��ܵζ�ǰ�����ݣ��ζ���������ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��I2��һ���������ܷ�����Ӧ��H2(g)+I2(g)![]() 2HI(g) ��H=��a kJ��mol-1��֪������˵����ȷ���ǣ� ��
2HI(g) ��H=��a kJ��mol-1��֪������˵����ȷ���ǣ� ��

A.H2��I2��HI�����еĻ�ѧ�����ǷǼ��Թ��ۼ�
B.��ͬ�����£�1 mol H2(g)��1 mol I2(g)��������С��2 mol HI(g)��������
C.�Ͽ�2 mol HI�����еĻ�ѧ����������ԼΪ(c+b+a)kJ
D.���ܱ������м���2 mol H2(g)��2 mol I2(g)����ַ�Ӧ��ų�������Ϊ2a kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�������FeCl3��Һ����ɫ��Ӧ��ʵ�����¡�����˵������ȷ����
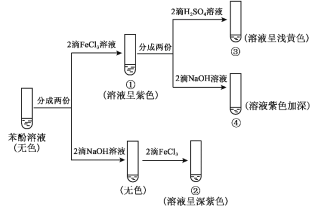
A.�ԱȢ٢��е�����˵���μ�ϡ�����c(Fe3+)��С
B.���Թܢ��еμ���������������Һ��ɫ��Ϊdz��ɫ
C.�ԱȢ٢ڡ��٢��е�����˵����ɫ���ʵ���������Һ�� c(C6H5O)���
D.�ԱȢ٢ڡ��٢��е�����˵�����C6H5O��������H+��Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ������Һ��Ũ�ȶԵ缫���Ƶ�Ӱ�죬�����Ũ���ء�ij������Ũ���ع���ԭ����ͼ��ʾ��ͨ��NH3ʱ��ؿ�ʼ���������缫�������٣��Ҳ�缫�������ӣ��м�AΪ�����ӽ���Ĥ���ŵ������÷��Ƚ��г����������֪��Cu2+��4NH3![]()
![]() ������˵������ȷ����
������˵������ȷ����
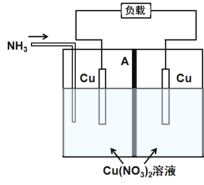
A.�ŵ�ʱ�����缫����������Ӧ��Cu��4NH3-2e��![]()
B.�ŵ�ʱ����ص��ܷ�ӦΪCu2����4NH3![]()
![]() ����H��0
����H��0
C.�ŵ�ʱ��![]() �����ӽ���Ĥ���Ҳ������Ǩ��
�����ӽ���Ĥ���Ҳ������Ǩ��
D.����ԭ��ص��γ�˵������ͬ�����£�![]() �������Ա�Cu2������������
�������Ա�Cu2������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼҵ��ԭ��ʾ��ͼ��ͼ������˵����ȷ����
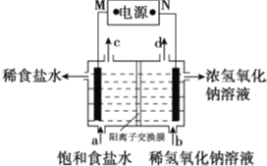
A. M����
B. ͨ��ʹ�Ȼ��Ʒ�������
C. ����c�ռ���������������
D. ͨ��һ��ʱ���������pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����120 ��ʱ�������������Ȼ�ϵ�ij���Ļ������� O2 ��һ�ܱ���������ȫ��Ӧ����֪��Ӧǰ���ѹǿû�б仯����û���������ǣ� ��
A.CH4��C2H4B.CH4��C2H6C.C2H4��C2H6D.C2H2��C3H6
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com