
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 在100mL的量筒里稀释浓硫酸溶液50mL | |
| D. | 用浓硫酸配制一定浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
分析 A.过量的试剂不能倒回试剂瓶中,防止污染试剂;
B.废液不能倒入水槽,避免污染地下水,应该倒入废液矼中;
C.稀释浓硫酸应该在烧杯中进行,不能用量筒;
D.浓硫酸稀释后放热,热溶液影响溶液体积,应该冷却后再转移到容量瓶中.
解答 解:A.过量的试剂不能倒回试剂瓶中,防止污染试剂,应放在指定的烧杯中,故A错误;
B.将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道,会污染地下水,应该将废液倒入废液矼中,故B错误;
C.不能用量筒稀释浓硫酸,应该在烧杯中稀释,故C错误;
D.用浓硫酸配制一定浓度的稀硫酸时,浓硫酸溶于水后放出大量热,热溶液影响配制溶液体积,应冷却至室温才能转移到容量瓶中,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及试剂取用、溶液配制、浓硫酸稀释等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:推断题
 如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:
如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
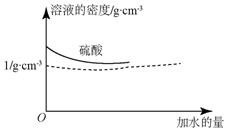 已知硫酸的密度与所加水量的关系如图所示,
已知硫酸的密度与所加水量的关系如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污 | |
| B. | 氧化铝的熔点很高,可用于制作耐高温材料 | |
| C. | C12、SO2均有漂白性,可使紫色石蕊溶液褪色 | |
| D. | 钠的金属性强于钾,工业上可用钠制取钾Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ② | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
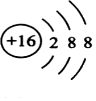
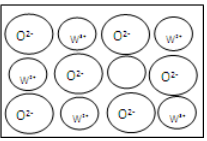 X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):
X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.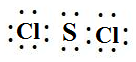 ,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.
,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.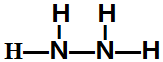 .常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.
.常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
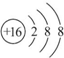 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com