
| A. | 水煤气只能用作燃料 | |
| B. | 水煤气是一种二级能源,比煤直接燃烧污染小 | |
| C. | 等质量的CO和H2完全燃烧时,前者放热多 | |
| D. | 由③反应可以确定H2的燃烧热为241.8 kJ•mol-1 |
分析 A.水煤气中含有CO、H2,可作还原剂使用;
B.将煤转化为水煤气,再将水煤气作为气体燃料,则水煤气间接得到;
C.根据②③计算反应放出的热量;
D.根据燃烧热的定义判断.
解答 解:A.因水煤气中含有CO、H2,则不仅可以作燃料,也可作还原剂使用,故A错误;
B.将煤转化为水煤气,再将水煤气作为气体燃料,则水煤气间接得到,所以水煤气属于二次能源,且水煤气的燃烧产物对环境无污染,故B正确;
C.根据②③可知,等质量的CO和H2完全燃烧时,氢气放出的热量多,故C错误;
D.反应热表示燃烧热时,生成的水为液态,为稳定状态,故D错误;
故选B.
点评 本题考查热化学反应及二次能源等知识,为高频考点,侧重化学与生活的考查,明确信息中的热化学反应及能源的分类即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2B溶液存在H2B | |
| B. | NaHB溶液一定显碱性 | |
| C. | NaHB溶液一定显酸性 | |
| D. | NaHB溶液与稀盐酸反应的离子方程式是HB-+H+=H2B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.24 g | B. | 22.8 g | C. | 17.02 g | D. | 24.84 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.8mL | B. | 2.4mL | C. | 3mL | D. | 4mL或1.2mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
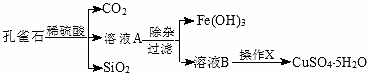
| 物质 | pH (开始沉淀) | pH④ (完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com