
| A. | +1 | B. | +3 | C. | +4 | D. | +6 |
科目:高中化学 来源: 题型:推断题
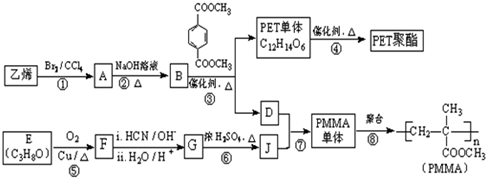
 $\underset{\stackrel{i.HCN/O{H}^{-}}{→}}{ii.{H}_{2}O/{H}^{+}}$
$\underset{\stackrel{i.HCN/O{H}^{-}}{→}}{ii.{H}_{2}O/{H}^{+}}$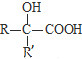 (R、R′代表烃基)
(R、R′代表烃基) .
.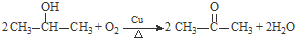 .
.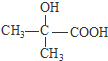 .
.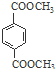 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH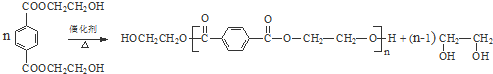 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量NaOH溶液,振荡后静置分液 | |
| B. | 除去干燥CO2中混有的少量SO2:将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 | |
| C. | 探究不同催化剂对H2O2分解速率的影响:在相同条件下,向两支试管均加入2 mL5%H2O2,然后同时分别加入少许等量MnO2固体粉末和FeCl3固体粉末,观察并比较实验现象 | |
| D. | 证明铁的金属性比铜强:常温下,分别向盛有浓硝酸的两支试管中加入铁粉和铜粉,观察并比较产生气体的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
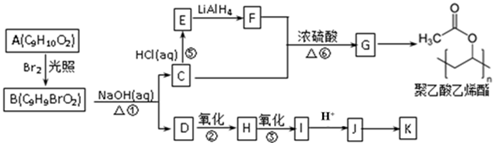
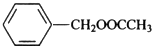 、
、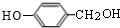 .
.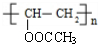 .
.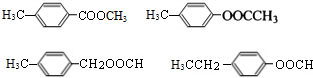 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-、Al3+、Na+、SO42- | B. | I-、NO3-、K+、NH4+ | ||
| C. | SiO32-、OH-、SO32-、Na+ | D. | MnO4-、Cl-、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,BA2分子中化学键属于共价键.
,BA2分子中化学键属于共价键. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com