
| A. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | Na2CO3溶液能使酚酞试液变红:CO32-+H2O?HCO3-+OH- | |
| C. | 0.lmol•L-l CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| D. | 向Mg(OH)2悬浊液中加入FeCl3溶液,出现红褐色沉淀:3Mg(OH)2(s)+2Fe3+(aq)═2Fe( OH)3(s)+3Mg2+(aq) |
分析 A.发生氧化还原反应生成硝酸铁、NO和水;
B.水解以第一步为主;
C.醋酸为弱酸,存在电离平衡;
D.发生沉淀的转化,生成更难溶的氢氧化铁.
解答 解:A.铁溶于稀硝酸,溶液变黄的离子反应为Fe+4H++NO3-═Fe3++NO↑+2H2O,故A错误;
B.Na2CO3溶液能使酚酞试液变红的离子反应为CO32-+H2O?HCO3-+OH-,故B正确;
C.0.lmol•L-l CH3COOH溶液的pH>1,电离方程式为CH3COOH?CH3COO-+H+,故C正确;
D.向Mg(OH)2悬浊液中加入FeCl3溶液,出现红褐色沉淀的离子反应为3Mg(OH)2(s)+2Fe3+(aq)═2Fe( OH)3(s)+3Mg2+(aq),故D正确;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及常见离子之间的反应为解答的关键,侧重水解、电离、沉淀转化、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 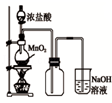 如图中:MnO2过量,盐酸能全部消耗 | B. | 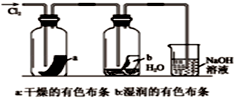 如图中:湿润的有色布条能褪色 | ||
| C. | 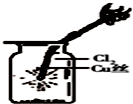 如图中:生成棕色的烟 | D. | 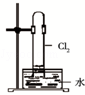 如图中:水可以充满试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨溶于的喷泉实验,说明氨气极易溶于水 | |
| B. | 常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性 | |
| C. | 氯气可使湿润的红色布条褪色,说明次氯酸具有漂白性 | |
| D. | 向蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸有吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,向20ml 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如图,回答下列问题:
常温下,向20ml 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
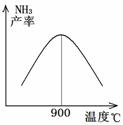 工业合成氨与制备硝酸一般可连续生产,流程如图所示:
工业合成氨与制备硝酸一般可连续生产,流程如图所示: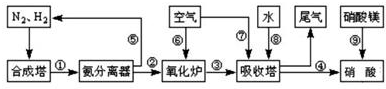
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com